ESTUDIO MICROTOMOGRÁFICO DE LA ANATOMÍA DE LAUBIERIOPSIS CABIOCHI (AMOUREUX, 1982) (ANNELIDA, FAUVELIOPSIDAE)
Julio Parapar1,*, Iria Permuy1, María Candás2, Xela Cunha-Veira2, José Luis Zamora3 & Juan Moreira3,4
1Departamento de Bioloxía, Universidade da Coruña, 15008 A Coruña, España. ORCID iD (JP): http://orcid.org/0000-0001-7585-6995 — ORCID iD (IP): http://orcid.org/0000-0001-5040-8475
2Estación de Bioloxía Mariña da Graña, Universidade de Santiago de Compostela, Ferrol, España. ORCID iD (MC): http://orcid.org/0000-0003-1047-3189 — ORCID iD (XC-V): http://orcid.org/0000-0002-0847-3086
3Departamento de Biología (Zoología), Facultad de Ciencias, Universidad Autónoma de Madrid. 28049 Madrid, España. ORCID iD (JLZ): http://orcid.org/0000-0001-5265-5859 — ORCID iD (JM): http://orcid.org/0000-0002-1374-2033
4Centro de Investigación en Biodiversidad y Cambio Global (CIBC-UAM), Universidad Autónoma de Madrid. 28049 Madrid, España.
*Autor para correspondencia: julio.parapar@udc.es
| |
RESUMEN
La Microtomografía Computarizada (micro-CT o μCT) es una técnica de estudio microestructural, no destructiva, que permite estudiar la anatomía interna y externa de muestras biológicas, y realizar su reconstrucción a través de un modelo virtual en tres dimensiones. En los últimos años esta técnica está aportando avances significativos en el conocimiento anatómico de diversos invertebrados marinos. En este trabajo se estudia la anatomía externa e interna de Laubieriopsis cabiochi (Amoureux, 1982) (Annelida, Fauveliopsidae) y paralelamente se valora la calidad de las imágenes de μCT frente a las obtenidas en estudios previos mediante métodos histológicos clásicos.
Palabras clave: Annelida; anatomía; Laubieriopsis; Micro-CT; proyecto BIOICE; Islandia.
|
| |
ABSTRACT
X-ray microtomography study of the anatomy of Laubieriopsis cabiochi (Amoureux, 1982) (Annelida, Fauveliopsidae)
Micro-computed tomography (micro-CT or μCT) is a microstructural, non-destructive, technique that allows the study of the external and internal anatomy of biological samples, and then allows for their reconstruction through 3D-virtual models. In the last years, this technique is providing significant advances in the knowledge of the anatomy of several marine invertebrate taxa. In this paper, we study the external and internal anatomy of Laubieriopsis cabiochi (Amoureux, 1982) (Annelida, Fauveliopsidae), comparing the quality of μCT images against those shown in previous works and obtained by classic histological methods.
Keywords: Annelida; anatomy; Laubieriopsis; Micro-CT; BIOICE project; Iceland.
|
IntroducciónTOP
Fauveliopsidae Hartman, 1971 es una pequeña familia de Anélidos marinos que se encuentra habitualmente en fondos de cierta profundidad (hasta 6.000 m), si bien algunas especies han sido localizadas en ambientes mucho más someros, por encima de los 100 m (Katzmann & Laubier, 1974; Riser, 1987; Núñez et al., 1997; López, 2011; López & Martínez, 2018). Su tamaño corporal oscila entre 1,3 y 20 mm de longitud y su número de segmentos es habitualmente menor de 30 (Rouse, 2001a). La familia comprende cerca de 20 especies bentónicas y detritívoras (Thiel et al., 2011; Zhadan & Atroshchenko, 2012; Zhadan & Salazar-Vallejo, 2014), repartidas en dos géneros: Fauveliopsis McIntosh, 1922 y Laubieriopsis Petersen, 2000 (López & Martínez, 2018).
La especie objeto de este estudio, Laubieriopsis cabiochi (Amoureux, 1982), muestra una organización corporal típica del género, con un cuerpo alargado, una región anterior ligeramente dilatada, que comprende el prostomio, peristomio y los tres primeros segmentos setígeros, y una región posterior de anchura uniforme, de sección cilíndrica, provista de 18 setígeros y que termina en un pigidio sencillo. La especie había sido descrita originalmente en aguas del Atlántico Norte dentro del género Fauveliopsis y fue posteriormente transferida al género Laubieriopsis por Petersen (2000). Además de su area typica, L. cabiochi ha sido citada en volcanes de fango del Golfo de Cádiz por Cunha et al. (2013) así como en el Océano Pacífico por Magalhaes et al. (2014). Descripciones recientes pueden encontrarse en Petersen (2000) y Magalhaes et al. (2014).
Los ejemplares examinados fueron recogidos durante las campañas BIOICE (Benthic Invertebrates of Icelandic Waters), las cuales han sido parte de un programa internacional para estudiar la fauna bentónica marina correspondiente al área económica exclusiva de Islandia (Meiβner et al., 2014). El área de muestreo de estas campañas cubrió un rango de profundidad comprendido entre 200 y 3.500 m a ambos lados de la cresta submarina (GIF Ridge) existente entre Groenlandia, Islandia y las Islas Feroe; en dicha cresta, el fondo marino se eleva hasta los 500 m de profundidad en su cúspide, marcando así una clara barrera geográfica entre las aguas frías del Océano Ártico al norte y las aguas más templadas del Atlántico Norte al sur (Thiel et al., 2011).
El examen de los ejemplares se ha realizado principalmente a través de microtomografía computarizada (micro-CT o μCT), la cual se basa en la creación de imágenes de rayos X mediante el mismo método utilizado en exploraciones de tomografía computarizada hospitalaria, aunque en este caso a pequeña escala y con una resolución muy superior (Bruker micro-CT, 2016). Los materiales densos que componen las muestras se pueden observar con esta técnica sin necesidad de preparaciones adicionales; sin embargo, con objeto de mejorar el contraste, en ocasiones los tejidos blandos requieren un tratamiento adicional con tinciones de alto peso molecular (Golding & Jones, 2007). En los últimos años, su empleo en estudios anatómicos en el ámbito de la zoología se está incrementando sensiblemente, particularmente en Moluscos y Artrópodos, si bien existen antecedentes también con Anélidos. Así, Dinley et al. (2010), Faulwetter et al. (2013a, 2013b, 2014) y Paterson et al. (2014) emplearon este método demostrando que las imágenes obtenidas pueden aportar detalles anatómicos muy relevantes. Recientemente, Parapar & Hutchings (2014) y Parapar et al. (2015a, 2015b, 2016, 2018a, 2019) han empleado el μCT en el estudio morfo-anatómico de varias especies de Anélidos (correspondientes a la antigua clase Polychaeta, ahora sin validez sistemática dada su naturaleza parafilética), continuando la exploración de sus posibilidades frente a otras técnicas anatómicas clásicas como la microscopía óptica y electrónica de barrido y las secciones histológicas.
El objetivo de este trabajo se centra en el estudio de la anatomía externa e interna de L. cabiochi utilizando por primera vez en esta familia la técnica de μCT, evaluando su efectividad frente a los estudios histológicos clásicos publicados sobre especies próximas (Zhadan & Atroshchenko, 2010; Purschke, 2011; Thiel et al., 2011), así como otros estudios recientes con otras especies de Anélidos poliquetos.
Material y métodosTOP
Se han empleado seis ejemplares de Laubieriopsis cabiochi recogidos durante las citadas campañas BIOICE frente a la costa noroeste de Islandia. Información detallada de las características abióticas de cada una de las estaciones y muestras recogidas en las distintas campañas de este proyecto puede encontrarse en el siguiente enlace: http://utgafa.ni.is/greinar/BIOICE_station_list_91-04_Paper_A2.pdf. Una descripción de la especie a partir de ejemplares de la zona puede encontrarse asimismo en Petersen (2000). Los ejemplares provienen de la muestra 2717, estación 734, campaña B-13-94, recogida el 07/09/1994 mediante un trineo epibentónico Rothlisberg-Pearcy (“RP”) a 256 m de profundidad y con una temperatura de fondo de 5,6°C frente a la península de Snaefellsness (64°30’30’’ N; 25°43’60’’ W). El proceso de triado de muestras, fijación inicial de los ejemplares en formol 4% y posterior inclusión en alcohol 70° para su conservación definitiva, se realizó en el Southwest Iceland Nature Research Centre, antes Sandgerdi Marine Centre (Reykjanes, Islandia). Inicialmente, tres ejemplares destinados al examen con μCT se sometieron a un mismo proceso de deshidratación a través de diferentes baños consecutivos de etanol a 80°, 90° y 96°, y metanol absoluto durante 24 horas cada uno. A continuación, cada ejemplar se trató de manera diferente. El primero (8,18 mm de longitud) no se sometió a ningún proceso de tinción, el segundo (6,46 mm) se tiñó con Iodina (IOD) al 1% en metanol durante una semana y el tercero (8,58 mm) se tiñó en Ácido Fosfotúngstico (PTA) al 1% en metanol durante tres días. Por último, los tres ejemplares se sometieron a un proceso de deshidratación con Hexametildisilazano (HMDS) durante 24 horas, dejándose secar posteriormente durante toda la noche con el objeto de eliminar el agua de los tejidos y aumentar la claridad y el contraste de las imágenes obtenidas tras el escaneo de la muestra en el μCT (Paterson et al., 2014). Las muestras se montaron en micropipetas siguiendo el método Bruker (Bruker microCT, 2016) y posteriormente se escanearon utilizando un microtomógrafo SkyScan 1172, a un voltaje de 55 kV, con una corriente de 165 μA, sin filtro, un tamaño de píxel de 1,5 μm y con una rotación de 180°. Las proyecciones de rayos X (radiografías) del escaneo se reconstruyeron con el Software NRecon, y posteriormente, las secciones transversales obtenidas fueron procesadas mediante los programas CTAn y DataViewer, que nos permitieron obtener cortes frontales y sagitales. Las representaciones en 3D fueron obtenidas con el programa CTVox.
Los tres ejemplares mencionados se encuentran depositados en el Museo Nacional de Ciencias Naturales de Madrid con los números de registro 16.01/18540 (ejemplar no teñido), 16.01/18441 (ejemplar teñido con Iodina) y 16.01/18542 (ejemplar teñido con PTA). De modo complementario, otros tres ejemplares procedentes de la misma muestra, pero no tratados para μCT, fueron asimismo depositados en el mismo museo con el número de registro 16.01/18543. Los “dataset” se encuentran a disposición de cualquier investigador que lo solicite poniéndose en contacto con el primer autor.
Abreviaturas empleadas en el texto y figuras
cc - cavidad celómica
cer (llv) - cerebro (lóbulos latero-ventrales)
cer (lmd) - cerebro (lóbulos medio-dorsales)
ces - constricción esofágica
cn - cordón nervioso
es - esófago
fa - faringe
int - intestino
le - luz esofágica
mesd - mesenterio dorsal
mesld - mesenterio lateral derecho
mesli - mesenterio lateral izquierdo
mesv - mesenterio ventral
mld - musculatura longitudinal dorsal
mlv - musculatura longitudinal ventral
mo - musculatura oblicua
mrpr(d) - músculo retractor del prostomio (dorsal)
mrpr(v) - músculo retractor del prostomio (ventral)
ms - musculatura setígera
msep - musculatura septo
neu - neuropodio
not - notopodio
ov - ovocitos
ovs - ovisaco
par - parápodo
pe - pared esofágica
per - peristomio
pg - papila genital
pi - papila interramal
pls - plexo sanguíneo
pr - prostomio
sed - sedas
sep - septo
st - setígero
vsd - vaso sanguíneo dorsal
vsv - vaso sanguíneo ventral
ResultadosTOP
A continuación, se presentan los resultados obtenidos tras el estudio de los seis ejemplares de Laubieriopsis cabiochi arriba citados, comparando el ejemplar no teñido con los que siguieron un proceso previo de tinción.
Anatomía externaTOP
La observación bajo la lupa binocular de los tres ejemplares no tratados para μCT (Fig. 1) muestra un cuerpo relativamente sencillo con forma de cigarro puro y sección sub-cilíndrica (Fig. 1A); la región anterior aparece ligeramente engrosada por la retracción, típica en el género, del prostomio y peristomio hacia el interior de los tres primeros setígeros (Figs. 1B-C), formando lo que se conoce en la literatura especializada como “introverto”. A continuación, se encuentra la región posterior en la que a su vez el pigidio puede estar retraído en el último segmento setígero (setígero 21) (Fig. 1D). Se pueden observar por transparencia ciertos elementos de la anatomía interna como el tubo digestivo, dividido en un esófago multilobulado anterior (Fig. 1C) y un largo intestino medio-posterior (Figs. 1B, D) no regionalizado, así como la presencia de voluminosas células sexuales femeninas en la región media del cuerpo asociadas a la papila genital localizada en la proximidad del setígero 9 (Fig. 1E).
|
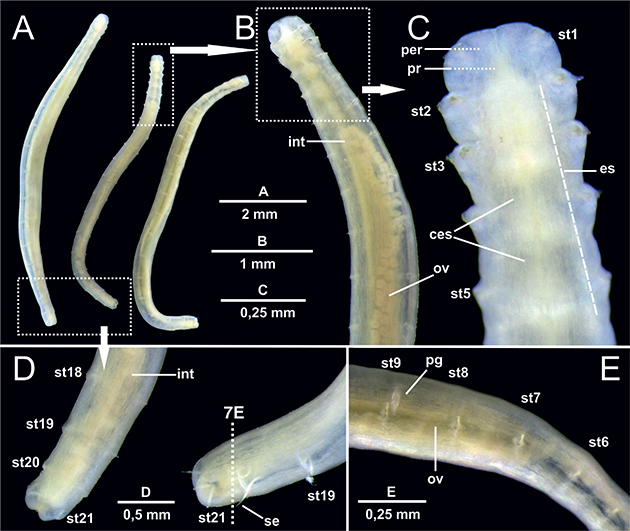 Fig. 1.— Laubieriopsis cabiochi. MNCN 16.01/18543. Imágenes al microscopio estereoscópico de la anatomía externa de tres ejemplares no tratados. A, aspecto general de los ejemplares; B, vista dorsal de la región anterior y media; C, detalle de la región anterior; D, extremo posterior; E, región media. Abreviaturas en el texto. Fig. 1.— Laubieriopsis cabiochi. MNCN 16.01/18543. Imágenes al microscopio estereoscópico de la anatomía externa de tres ejemplares no tratados. A, aspecto general de los ejemplares; B, vista dorsal de la región anterior y media; C, detalle de la región anterior; D, extremo posterior; E, región media. Abreviaturas en el texto.
Fig. 1.— Laubieriopsis cabiochi. MNCN 16.01/18543. Stereomicroscope images of the external anatomy of non-treated specimens. A, general view of the specimens; B, dorsal view of anterior end and midbody; C, detail of the anterior region D, posterior end; E, midbody. Abbreviations in the text.
|
|
El examen por medio de μCT del ejemplar no teñido muestra una superficie corporal lisa sin ningún tipo de diferenciación cuticular especial aparte de un par de parápodos latero-dorsales en cada segmento corporal, así como un poro genital impar entre los setígeros 8 y 9 (Figs. 2B-C, 6D). Las imágenes obtenidas a partir del ejemplar teñido con PTA (Figs. 2A, 9A) muestran mayor definición que en el caso del ejemplar no teñido (Figs. 2B-C) o del teñido con Iodina (Figs. 8A, C). La región corporal anterior (prostomio + peristomio + setígeros 1-3) aparece más ancha que el resto del cuerpo, tanto en el ejemplar no teñido como en el teñido con Iodina (Figs. 2B-C, 8A), debido a la retracción del prostomio y peristomio hacia el espacio determinado por los tres setígeros anteriores. Por el contrario, en el ejemplar teñido con PTA, en el cual esta invaginación es solamente parcial, afectando únicamente al peristomio,
la observación externa del prostomio es posible, mostrándose de pequeño tamaño y forma cónica (Figs. 2A, 9C). A partir del setígero 4 (“setígero de transición”), se encuentran el resto de los segmentos corporales, que son algo más estrechos y largos que los anteriores, estando todos provistos de parápodos típicamente birrámeos con ramas dorsales (notópodos) y ventrales (neurópodos) muy poco desarrolladas, dotadas de una pequeña papila sensorial interramal (Figs. 5D-F) y de un pequeño número de sedas de tipo acicular poco visibles con esta técnica (Figs. 2A, 5B, D-F). En el extremo posterior se localiza el pigidio, invaginado en todos los ejemplares hacia el interior del último segmento (Fig. 1D). Además de los parápodos y sedas, el único elemento destacable en toda la superficie corporal es la papila genital, localizada en el lado derecho del setígero 8, en posición latero-posterior, y muy cerca del parápodo correspondiente al setígero 9 (Figs. 2B-C, 9A).
|
 Fig. 2.— Laubieriopsis cabiochi. MNCN 16.01/18540 y MNCN 16.01/18542. Imágenes μCT en 3D de la anatomía externa. A, vista dorsal de la región anterior del ejemplar teñido con PTA; B-C, vista dorsal y lateral derecha del ejemplar sin teñir. Abreviaturas en el texto. Fig. 2.— Laubieriopsis cabiochi. MNCN 16.01/18540 y MNCN 16.01/18542. Imágenes μCT en 3D de la anatomía externa. A, vista dorsal de la región anterior del ejemplar teñido con PTA; B-C, vista dorsal y lateral derecha del ejemplar sin teñir. Abreviaturas en el texto.
Fig. 2. — Laubieriopsis cabiochi. MNCN 16.01/18540 and MNCN 16.01/18542. μCT 3D-images of the external anatomy. A, dorsal view of anterior region of the PTA-stained specimen; B-C, dorsal and right lateral view of the unstained specimen. Abbreviations in the text.
|
|
Anatomía internaTOP
La técnica del μCT ha mostrado su mayor potencial en el examen de la anatomía interna, aportando información muy diversa y comparable a la ofrecida mediante otras técnicas de estudio estructural, con imágenes muy fieles de los órganos internos,
tanto de su forma como su posición espacial.
Al igual que la mayoría de los Anélidos, L. cabiochi muestra una amplia cavidad corporal celómica, que, de acuerdo con la típica metamerización anelidiana, se encuentra dividida en cavidades más o menos individualizadas mediante septos. Estos últimos están especialmente bien desarrollados en los setígeros
3-5; al estar dotados de abundantes fibras musculares en su región dorsal son muy visibles tanto en las imágenes 3D (Fig. 3B) como 2D (Fig. 9B). Este aspecto a su vez determina la forma del tramo anterior del digestivo, particularmente en los animales con el introverto retraído (ver abajo).
|
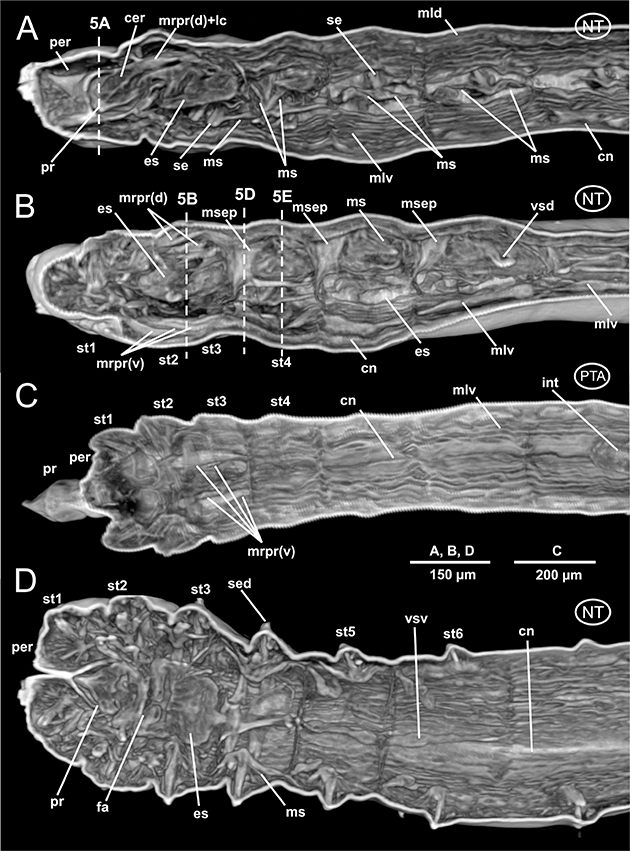 Fig. 3.— Laubieriopsis cabiochi. MNCN 16.01/18540 y MNCN 16.01/18542. Imágenes μCT en 3D de la anatomía interna. A-B, dos cortes parasagitales del ejemplar sin teñir; C, corte frontal del ejemplar teñido con PTA; D, corte frontal del ejemplar sin teñir. Abreviaturas en el texto. Fig. 3.— Laubieriopsis cabiochi. MNCN 16.01/18540 y MNCN 16.01/18542. Imágenes μCT en 3D de la anatomía interna. A-B, dos cortes parasagitales del ejemplar sin teñir; C, corte frontal del ejemplar teñido con PTA; D, corte frontal del ejemplar sin teñir. Abreviaturas en el texto.
Fig. 3.— Laubieriopsis cabiochi. MNCN 16.01/18540 and MNCN 16.01/18542. μCT 3D-images of the internal anatomy. A-B, two parasagittal sections of the unstained specimen; C, frontal section of the PTA-stained specimen; D, frontal section of the unstained specimen. Abbreviations in the text.
|
|
La musculatura de la pared corporal está muy bien desarrollada y organizada en cuatro paquetes de fibras de orientación longitudinal,
individualizados y enmarcando la cavidad corporal general; dos dispuestos en posición dorsal y dos en posición ventral (Figs. 3A-D, 5D, 6A-C). No se observa musculatura parietal circular, pero sí gruesos paquetes musculares asociados tanto al movimiento de los parápodos como de sus sedas (Figs. 5C-D) así como con la retracción del introverto. En el primer caso, estos músculos se localizan uniendo la línea medio-ventral corporal con la pared corporal lateral o la base del parápodo (Figs. 5B-F); en el segundo caso unen el borde posterior del prostomio con la pared corporal a la altura de los setígeros 2 y 3, tanto dorsal como ventralmente (Figs. 4A, C, 5B-C).
|
 Fig. 4.— Laubieriopsis cabiochi. MNCN 16.01/18540 y MNCN 16.01/18542. Imágenes μCT en 3D de la anatomía interna. A-B, dos cortes frontales (A: dorsal; B:
ventral) del ejemplar sin teñir; C, corte frontal de un ejemplar teñido con PTA. Las líneas discontinuas muestran la ubicación de los cortes transversales mostrados en las figuras 5 y 6. Abreviaturas en el texto. Fig. 4.— Laubieriopsis cabiochi. MNCN 16.01/18540 y MNCN 16.01/18542. Imágenes μCT en 3D de la anatomía interna. A-B, dos cortes frontales (A: dorsal; B:
ventral) del ejemplar sin teñir; C, corte frontal de un ejemplar teñido con PTA. Las líneas discontinuas muestran la ubicación de los cortes transversales mostrados en las figuras 5 y 6. Abreviaturas en el texto.
Fig. 4.— Laubieriopsis cabiochi. MNCN 16.01/18540 and MNCN 16.01/18542. μCT 3D-images of the internal anatomy. A-B, two frontal sections (A: dorsal; B: ventral)
of the unstained specimen; C, frontal section of the PTA-stained specimen. Dashed lines show the location of transversal sections as shown in figures 5 and 6. Abbreviations in the text.
|
|
El aparato digestivo es rectilíneo. Al igual que ocurre en otros poliquetos, y laubieriópsidos en particular, L. cabiochi presenta un digestivo diferenciado en dos regiones. Los aspectos más relevantes son: 1) faringe muy corta, justamente detrás de la boca (Fig. 3D); 2) región esofágica también corta (Figs. 5B-F, 6C, 8B-C, 9C), mucho más marcada y lobulada debido a la interiorización del introverto y especialmente a fuertes estrechamientos en su trayecto que coinciden con la presencia de los septos anteriores musculados dorsalmente, ya referidos anteriormente (Figs. 4A-C, 5C-F, 8C, 9C); 3) un intestino largo y recto, de sección cilíndrica (Figs. 6A-B, 8B, 9B), en ocasiones lleno de sedimento (Fig. 6B), el cual conecta con el ano a través de un recto corto, poco diferenciado (Fig. 7E). El sistema digestivo discurre en posición medio-dorsal por el interior de la cavidad celómica sostenido por los antedichos septos, así como por mesenterios dorsales y ventrales en forma de prolongaciones del propio peritoneo celómico, que lo sujetan uniéndolo a la cara interna dorsal y ventral de la pared corporal. Estos mesenterios están presentes a lo largo de todo el digestivo, pero al igual que los septos son más evidentes en la región anterior en estrecha asociación con la región esofágica
(Figs. 6C, 7B), si bien en las imágenes 2D del individuo no teñido su presencia también es evidente en la región posterior (Figs. 7D-E). En este último caso, se observa una especial disposición anatómica del tramo final rectal, apareciendo en posición dorsal y muy próximo a la musculatura dorsal parietal, pero manteniéndose unido a la zona ventral por tres aparentes mesenterios ventrales (Fig. 7E); además, la presencia del vaso subentérico no es tan evidente como en un corte de la región media (Fig. 7D).
|
 Fig. 5.— Laubieriopsis cabiochi. MNCN 16.01/18540 y MNCN 16.01/18542. Imágenes μCT en 3D de la anatomía interna del ejemplar sin teñir (A, B, D, E) y teñido con PTA (C, F). Cortes transversales a nivel de: A, prostomio; B, esófago anterior (prostomio invaginado); C, esófago anterior
(prostomio no invaginado); D, esófago posterior; E y F, constricción esofágica. Abreviaturas en el texto. Fig. 5.— Laubieriopsis cabiochi. MNCN 16.01/18540 y MNCN 16.01/18542. Imágenes μCT en 3D de la anatomía interna del ejemplar sin teñir (A, B, D, E) y teñido con PTA (C, F). Cortes transversales a nivel de: A, prostomio; B, esófago anterior (prostomio invaginado); C, esófago anterior
(prostomio no invaginado); D, esófago posterior; E y F, constricción esofágica. Abreviaturas en el texto.
Fig. 5.— Laubieriopsis cabiochi. MNCN 16.01/18540 and MNCN 16.01/18542. μCT 3D-images of the internal anatomy of the unstained (A, B, D, E) and PTA-stained specimen (C, F). Transversal section at the level of: A, prostomium; B, anterior oesophagus (invaginated prostomium); C, anterior oesophagus (non-invaginated prostomium); D, posterior oesophagus; E & F, oesophagic constriction. Abbreviations in the text.
|
|
|
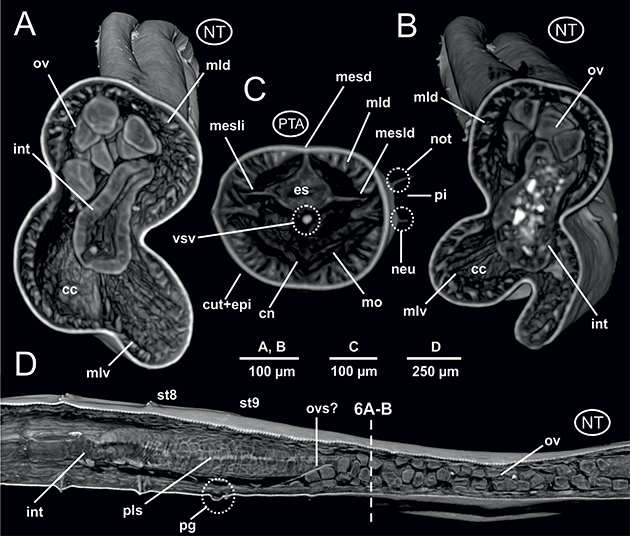 Fig. 6.— Laubieriopsis cabiochi. MNCN 16.01/18540 y MNCN 16.01/18542. Imágenes μCT en 3D de la anatomía interna del ejemplar sin teñir (A, B, D) y teñido con PTA (C). Cortes transversales a nivel del intestino (A, B) y del esófago (C) y un corte parasagital a nivel de la región corporal media (D). Abreviaturas en el texto. Fig. 6.— Laubieriopsis cabiochi. MNCN 16.01/18540 y MNCN 16.01/18542. Imágenes μCT en 3D de la anatomía interna del ejemplar sin teñir (A, B, D) y teñido con PTA (C). Cortes transversales a nivel del intestino (A, B) y del esófago (C) y un corte parasagital a nivel de la región corporal media (D). Abreviaturas en el texto.
Fig. 6.— Laubieriopsis cabiochi. MNCN 16.01/18540 and MNCN 16.01/18542. μCT 3D-images of the internal anatomy of the unstained (A, B, D) and PTA-stained specimen (C). Transversal sections at the level of intestine (A, B) and oesophagus (C) and parasagittal section at midbody
(D). Abbreviations in the text.
|
|
|
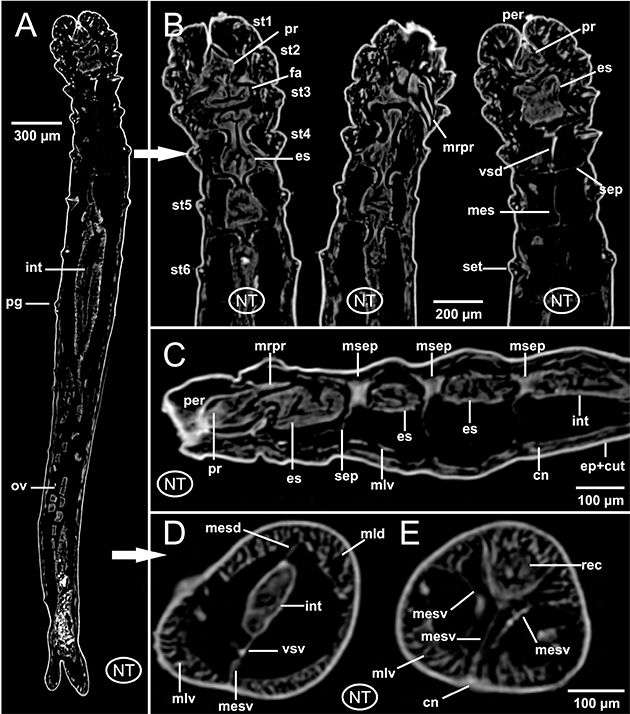 Fig. 7.— Laubieriopsis cabiochi. MNCN 16.01/18540. Imágenes μCT en 2D de la anatomía interna del ejemplar no teñido. A, corte frontal; B, tres detalles de la región anterior a diferentes niveles dorsoventrales; C, corte sagital de la región anterior; D-E, dos cortes transversales del intestino en la región media y posterior (recto) respectivamente. Abreviaturas en el texto. Fig. 7.— Laubieriopsis cabiochi. MNCN 16.01/18540. Imágenes μCT en 2D de la anatomía interna del ejemplar no teñido. A, corte frontal; B, tres detalles de la región anterior a diferentes niveles dorsoventrales; C, corte sagital de la región anterior; D-E, dos cortes transversales del intestino en la región media y posterior (recto) respectivamente. Abreviaturas en el texto.
Fig. 7.— Laubieriopsis cabiochi. MNCN 16.01/18540. μCT 2D-images of the internal anatomy of the unstained specimen. A, frontal section; B, three detailed images of anterior region at several dorsoventral levels; C, sagittal section of anterior region; D-E, two transversal sections of the intestine at middle (D) and posterior -rectum- (E) regions. Abbreviations in the text.
|
|
El sistema circulatorio anelidiano se organiza fundamentalmente en dos vasos sanguíneos largos, uno dorsal y otro ventral al aparato digestivo. Estos vasos están asociados a septos y mesenterios, y a ellos se les une un sistema de vasos segmentarios que los pone en contacto con los distintos órganos internos. En este estudio, el vaso sanguíneo dorsal resulta difícil de detectar, si bien su presencia es evidente en ciertos tramos de la región anterior (Fig. 3B); por el contrario, el vaso longitudinal ventral es más patente a lo largo de toda la región anterior, muy próximo a la cara ventral esofágica (Figs. 4B, 5E, 6C, 9C) pero también en la mitad del cuerpo (Fig. 7D). Asimismo, imágenes parasagitales del ejemplar no teñido muestran aparentemente vasos de menor calibre formando un plexo sanguíneo bien definido asociado a la cara externa del intestino (Fig. 6D), al menos a la altura de los setígeros 8 y 9.
El sistema nervioso anelidiano consta básicamente de un cerebro anterior de ubicación prostomial (sobre todo en poliquetos)
y por tanto dorsal y de un cordón nervioso ventral largo y metamerizado, formado por un par de ganglios por segmento más o menos fusionados y de los que parten ramas nerviosas que inervan los distintos elementos corporales. Ambos elementos se ponen en contacto por medio de un par de conectivos nerviosos que rodean a la región anterior del digestivo, a menudo la faringe o el esófago. Este esquema general con una región cerebral y sus lóbulos dorsales y ventrales (Figs. 4A, C, 8B) y una cadena nerviosa ventral (Figs. 3A-B, D, 5A-F, 6C, 9C) se ha encontrado también en L. cabiochi, si bien los conectivos circunfaríngeos no se han podido observar claramente con ninguna de las técnicas empleadas.
|
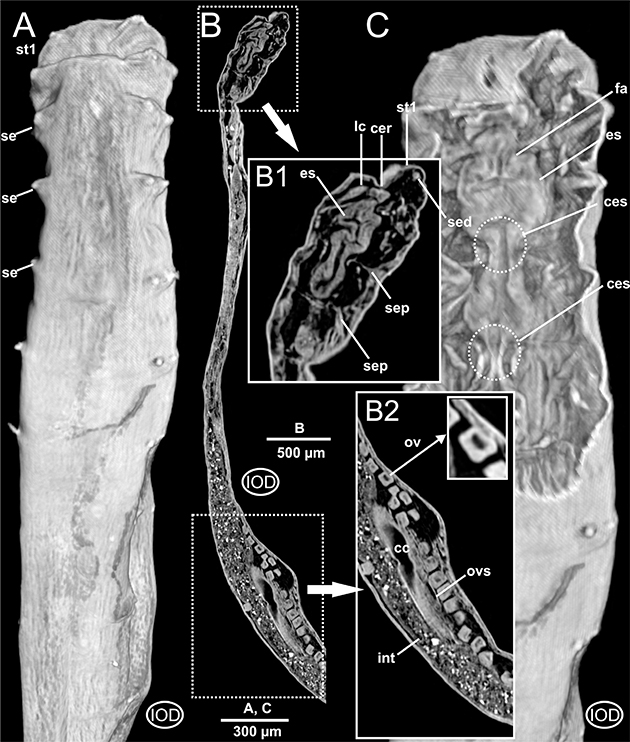 Fig. 8.— Laubieriopsis cabiochi. MNCN 16.01/18541. Imágenes μCT en 3D (A y C) y 2D (B) de la anatomía externa e interna del ejemplar teñido con Iodina. Abreviaturas en el texto. Fig. 8.— Laubieriopsis cabiochi. MNCN 16.01/18541. Imágenes μCT en 3D (A y C) y 2D (B) de la anatomía externa e interna del ejemplar teñido con Iodina. Abreviaturas en el texto.
Fig. 8. — Laubieriopsis cabiochi. MNCN 16.01/18541. μCT 3D (A, C) and 2D (B) images of the external and internal anatomy of the Iodine-stained specimen. Abbreviations in the text.
|
|
|
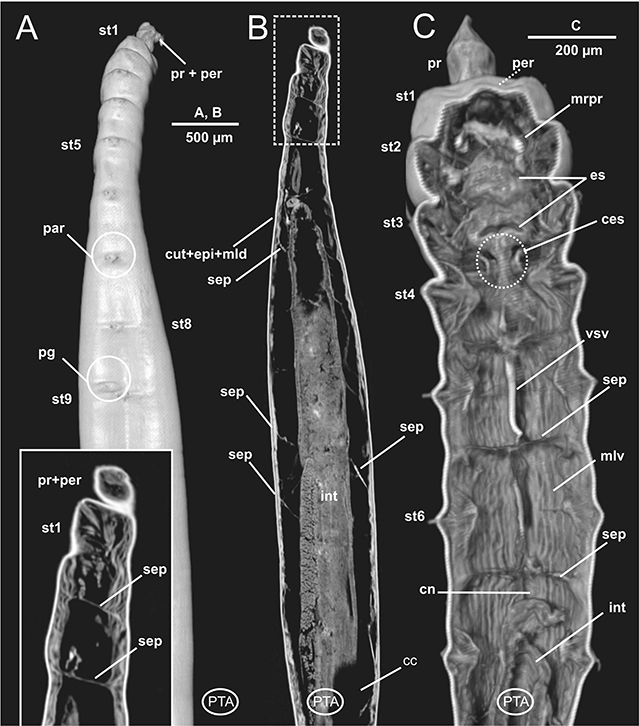 Fig. 9.— Laubieriopsis cabiochi. MNCN 16.01/18542. Imágenes μCT en 3D (A y C) y 2D (B) de la anatomía interna del ejemplar teñido con PTA. Abreviaturas en el texto. Fig. 9.— Laubieriopsis cabiochi. MNCN 16.01/18542. Imágenes μCT en 3D (A y C) y 2D (B) de la anatomía interna del ejemplar teñido con PTA. Abreviaturas en el texto.
Fig. 9. — Laubieriopsis cabiochi. MNCN 16.01/18542. μCT 3D (A, C) and 2D (B) images of the internal anatomy of the PTA-stained specimen. Abbreviations in the text.
|
|
El aparato reproductor de los poliquetos está muy simplificado en comparación al de los Anélidos Clitelados, en los cuales está dotado de elementos altamente especializados y bien definidos, y siempre ubicado en una posición corporal específica,
siendo considerados como un carácter taxonómico relevante. En los poliquetos, las gónadas suelen ser simples masas de gametos en desarrollo asociadas a la pared peritoneal, localizadas habitualmente a lo largo de gran parte del cuerpo y por tanto con una posición mucho menos definida. Tras las fases iniciales del desarrollo de los gametos en el interior gonadal, éstos suelen continuar su desarrollo en el líquido celómico a la espera de ser evacuados, ya sea por gonoporos o nefridioporos, o bien a través de la rotura de la pared corporal. En el caso que nos ocupa, su liberación ocurriría a través del gonoporo localizado en el setígero 8 y mencionado anteriormente. Ninguno de los tres ejemplares de L. cabiochi parece presentar de modo evidente masas gonadales; sin embargo, el ejemplar no teñido presenta grandes células sexuales femeninas
(ovocitos) en el espacio celómico y especialmente a partir del setígero 9 (Figs. 6A-B, D, 8B).
DiscusiónTOP
El examen de poliquetos por medio de microtomografía computarizada (μCT) (p. ej. Parapar et al., 2015a, 2015b, 2016, 2018a, 2018b, 2019) ha revelado que las imágenes tanto de su anatomía externa como interna son un buen complemento de aquellas obtenidas mediante el estudio histológico tradicional. Este hecho resulta particularmente relevante para estudios de reconstrucción anatómica,
la cual, tanto en -poliquetos como en Clitelados (p. ej. Fernández et al., 2014; Fend et al., 2017) y Moluscos Solenogastros (p. ej. Pedrouzo et al., 2014), ha sido tradicionalmente abordada a partir de cortes histológicos seriados, que implican una alteración de la integridad de los ejemplares. Por ello, una de las mayores ventajas de las disecciones virtuales obtenidas con μCT es la de permitir el estudio de los distintos órganos internos sin destruir el ejemplar, ofreciendo además la posibilidad de observar su posición espacial natural, la cual puede verse sensiblemente alterada durante la realización de los cortes histológicos.
Riser (1987), Zhadan & Atroshchenko (2010, 2012) y Zhadan & Salazar-Vallejo (2014) estudiaron la anatomía interna de Laubieriopsis arenicola (Riser, 1987) y Laubieriopsis norvegica Zhadan & Atroshchenko, 2012 respectivamente; la segunda especie es muy próxima tanto taxonómica como geográficamente a los ejemplares de L. cabiochi estudiados aquí, si bien su examen se realizó empleando técnicas histológicas. Los resultados obtenidos en estos trabajos muestran en términos generales los mismos elementos corporales descritos en nuestro estudio, y cuya diferencia fundamental,
particularmente en los trabajos de Zhadan y colaboradores, radica en la obtención de imágenes de mucha mayor resolución, a nivel tisular y celular.
En el caso de la anatomía externa, a diferencia de otros poliquetos, pocos son los elementos anatómicos destacables en Laubieriopsis. Sin embargo, las denominadas “papilas epidérmicas” localizadas bajo las papilas interramales de los parápodos citadas por
Zhadan & Atroshchenko (2010) para Laubieriopsis norvegica, no han sido identificadas en nuestros ejemplares. Por el contrario, estos elementos sí han sido detectados en otros individuos estudiados al Microscopio Electrónico de Barrido (MEB, resultados no incluidos en este estudio) lo cual revela ciertas limitaciones del μCT en el estudio de la anatomía externa. Asimismo, es destacable la baja definición de las imágenes obtenidas de las sedas, de calidad muy inferior a las logradas con el MEB o la microscopía óptica, lo cual corrobora lo visto en otros casos con otras especies de poliquetos (p.ej. Parapar et al., 2017, 2018a, 2018b, 2019).
En cuanto a la anatomía interna, hemos encontrado ciertos aspectos no descritos en los trabajos mencionados anteriormente.
En primer lugar, la distinción entre la región “esofágica” e “intestinal” (sensu Riser, 1987 y Zhadan & Atroshchenko, 2010) es evidente, pero, por el contrario, no se ha distinguido claramente la presencia de la faringe, ya sea en los cortes longitudinales o transversales, ni la diferente naturaleza de su pared dorsal y ventral mencionada por Zhadan & Atroshchenko (2010; fig. 3A). Los dos componentes más voluminosos del sistema muscular (capa longitudinal parietal dorsal y ventral y músculos retractores del prostomio) que describieron estos autores son claramente patentes en las imágenes de μCT, pero también lo son los gruesos músculos asociados al movimiento de las sedas parapodiales, no mencionados por ellos. Finalmente, se confirma también la presencia de un vaso sanguíneo longitudinal ventral al tubo digestivo, así como de otro dispuesto dorsalmente respecto a éste. Ambos habían sido previamente referidos por Zhadan y colaboradores, si bien éstos reconocen que este último es de menor diámetro.
Finalmente, se ha observado un posible plexo sanguíneo en íntima relación con el intestino a la altura, al menos, de los setígeros
8-9, una característica que es común en poliquetos (Rouse & Pleijel, 2001) pero no mencionada por Zhadan & Atroshchenko (2010).
La técnica de μCT no necesita un tratamiento complejo de las muestras, en todo caso mucho más sencillo que la realización de cortes histológicos. Sin embargo, presenta ciertas limitaciones en cuanto a la calidad de las imágenes resultantes. Esto es debido a que el escaneo y reconstrucción posterior de las imágenes se basa en la densidad a los rayos X de los distintos elementos corporales, por lo que aquellos órganos con densidades similares son difíciles de discriminar entre sí. Asimismo no aporta información en cuando a la naturaleza celular de sus componentes siendo esto una de sus principales desventajas en relación con las imágenes obtenidas a partir de técnicas histológicas. Este hecho es evidente con respecto a la pared corporal y sobre todo al sistema nervioso. Así, las imágenes de μCT tanto en 2D como en 3D muestran una pared del cuerpo y de los órganos internos muy simplificada respecto a las obtenidas mediante histología (Zhadan & Atroshchenko, 2010). En el caso de la pared corporal, la capa cuticular y epidermis subyacente se corresponderían con una simple línea blanca,
diferenciándose únicamente de la musculatura longitudinal subyacente por su menor densidad a los rayos X, y bajo la cual la capa celular peritoneal tampoco es distinguible. La cadena nerviosa ventral aparece poco o nada ganglionada (Zhadan & Atroshchenko, 2010), y se distingue claramente frente a la musculatura longitudinal ventral que la flanquea; sin embargo, la morfología, anatomía y posición espacial del cerebro solo se ha podido inferir a partir de su posición intraprostomial ya referida por otros autores (Zhadan & Atroshchenko, 2010; Purschke, 2011). Los lóbulos cerebrales posteriores, tanto los latero-ventrales descritos por Zhadan y Atroshchenko (2010) como los medio-dorsales observados por Thiel et al., (2011) en Laubieriopsis confusa Thiel, Purschke & Böggemann, 2011, no se pueden diferenciar claramente de los músculos retractores prostomiales entre los cuales se localizan, a pesar de su supuesta diferente densidad (Figs. 4A, C). En el mismo sentido, las imágenes microtomográficas no muestran con detalle la naturaleza histológica fina del cerebro; por ejemplo, el neuropilo, muy evidente en las imágenes de Thiel et al. (2011), no ha podido ser detectado.
En relación con estos dos elementos anatómicos, las secciones transversales obtenidas con μCT han revelado, sin embargo, la presencia de un elemento corporal muy bien definido y curiosamente no registrado anteriormente para esta familia. Se trata de unas fibras muy evidentes dispuestas entre la línea medio-ventral corporal (aparentemente asociadas a una cadena nerviosa)
y la pared corporal lateral. Estos elementos (Fig. 5) podrían corresponder a ramas nerviosas segmentarias o bien, dado su diámetro y densidad, a paquetes de musculatura oblicua; dicha musculatura no ha sido reportada por Zhadan & Atroshchenko (2010) para L. norvegica, si bien su presencia es muy común entre los poliquetos (Rouse, 2001b; Rouse & Pleijel, 2001), como es el caso de Cossura pygodactylata Jones, 1956 (Zhadan et al., 2014; Parapar et al., 2018a).
Las imágenes 2D se han revelado complementarias a las 3D, pues si bien con las primeras se pierde la información volumétrica de la muestra -sí aportada por las segundas- se gana en la definición de los límites de los distintos elementos anatómicos, particularmente de aquellos más delicados o de menor tamaño, y que por tanto podrían llegar a pasar desapercibidos entre el gran volumen de información aportada por las imágenes 3D. Este es el caso de los septos y mesenterios y su relación con la región esofágica del digestivo, cuya presencia en las imágenes 2D es mucho más evidente que en las 3D (Figs. 3B y 4B vs. 7C y 7B).
El análisis comparativo de los resultados obtenidos con los ejemplares teñidos con Iodina y PTA frente al no teñido muestra, en coherencia con resultados de trabajos anteriores como Metscher (2009a) con Vertebrados y otros grupos de Invertebrados, afinidades diferentes por los distintos tejidos en los primeros. Así, mientras que la tinción con Iodina se asocia tanto a los tejidos blandos como a las estructuras calcificadas y polisacáridos, destacando en este caso derivados epidérmicos como la cutícula, mandíbulas y ciertos tipos de sedas, el PTA lo hace a proteínas como la fibrina y el colágeno, destacado más el tejido epidérmico que la anterior, así como las fibras musculares (Faulwetter et al., 2013a, 2013b). En nuestro estudio, el ejemplar que mostró una reconstrucción posterior con imágenes más detalladas en términos generales fue el no teñido, mientras que el teñido con Iodina mostró resultados de inferior calidad. Sin embargo, el tratado con PTA aportó imágenes muy comparables a las del ejemplar no teñido, superándolo en términos de nitidez de la superficie corporal
(Fig. 2A vs. 2B-C) así como también en ciertos casos de estructuras internas sobre todo de naturaleza muscular, como la musculatura oblicua y la retractora prostomial, tan característica de esta familia; todo ello corrobora las observaciones de los autores citados anteriormente. Por su parte, las imágenes tanto del tejido nervioso como del circulatorio, salvo en el caso de la cadena nerviosa ventral y el vaso sanguíneo subentérico respectivamente, no han mostrado, por el contrario, el mismo grado de nitidez.
La presencia potencial de un plexo circulatorio asociado al intestino observado en el individuo sin teñir podría ser un aspecto novedoso en el conocimiento anatómico de los fauveliópsidos. Sin embargo, la falta de réplicas no permite confirmar su existencia de forma definitiva, pues la posibilidad de artefactos en las imágenes es un hecho constatado en estudios recientes con otras especies de poliquetos mediante esta técnica (Parapar et al., 2018a, 2018b, 2019). En este sentido, hemos detectado un nuevo ejemplo de artefacto en relación con los estrechamientos del esófago. Como puede observarse en la figura 4A, en imágenes coronales de la zona ventral del cuerpo, aparecen estructuras asociadas a estas zonas, entre los setígeros 4-5 y 5-6, que podrían, particularmente en el segundo caso, asociarse a un ganglio de la cadena nerviosa ventral. Se descarta que puedan ser elementos nerviosos pues tanto aquí como en estudios anteriores se reconoce que la cadena nerviosa ventral en Laubieriopsis está mínimamente ganglionada, por lo que esta imagen muy posiblemente se trate realmente del encuentro del revestimiento interno a ambos lados del esófago a este nivel, como se muestra en el corte transversal al mismo nivel en la figura 5D.
El principal problema de los organismos que presentan un cuerpo blando, como es el caso de los Anélidos, radica en que la absorción de los rayos X es comparativamente mucho menor que la de aquellos que muestran elementos duros como la concha de Moluscos (Marcondes Machado et al., 2019), espículas de Poríferos (Heim & Nickel, 2010), estatolitos de Cnidarios Escifozoos (Holst et al., 2016) o el exoesqueleto de Artrópodos (Sombke et al., 2015); por lo tanto, las imágenes resultantes tienen una resolución diferencial comparativamente mucho menor. Las estructuras duras que presentan algunos poliquetos como paragnatos en la probóscide de Nereididae, papilas faríngeas de Phyllodocidae, opérculos de Serpulidae o sedas de gran tamaño (p. ej. paleas de Ampharete), pueden ser visualizadas perfectamente (ver Parapar et al., 2017, 2018a, 2018b), pero en la mayoría de los caracteres internos (p. ej. sistema muscular, digestivo y nervioso) puede resultar difícil discriminar la naturaleza de cada uno de sus componentes. En este sentido, es muy importante tener en cuenta el tipo de tinción a emplear; de hecho, la mayoría de las tinciones que se utilizan en microtomografía no son específicas, a diferencia de las empleadas en histología, de las que muchas han sido diseñadas específicamente para destacar tejidos o células particulares. La mayoría de las tinciones utilizadas para μCT se emplean para simplemente mejorar el contraste, pero no para discriminar entre distintos tejidos (Golding & Jones, 2007) aunque en algunos trabajos posteriores ya hay avances significativos en este sentido, si bien no en Anélidos (Metscher, 2009a, 2009b). Otro problema añadido radica en que estas tinciones tienen que ser capaces de penetrar lo más profundamente posible en la muestra, y ser de un peso molecular suficiente como para absorber eficazmente los rayos X, lo cual se ve obstaculizado por la baja permeabilidad, frente al material fresco, de las muestras previamente deshidratadas en alcohol (Paterson et al., 2014).
AgradecimientosTOP
Este estudio ha sido parcialmente financiado por el proyecto de Investigación “Fauna Ibérica: Polychaeta VI. Palpata. Canalipalpata I” (CGL2014-53332-C5-3-P). Los autores desean expresar su agradecimiento a los responsables del proyecto BIOICE por la cesión de los ejemplares y en particular a G.V. Helgason (Rorum ehf.; Islandia) y G. Gudmundsson (Icelandic Institute of Natural History) así como a A. Zhadan (Moscow State University) por su ayuda en la identificación de algunos elementos de la anatomía interna. Los autores desean agradecer la evaluación del manuscrito por parte de Javier Alba-Tercedor así como de un revisor anónimo, las cuales han contribuido significativamente a la mejora del texto.
ReferenciasTOP
| ○ |
Bruker-MicroCT. 2016. Chemical Drying of Specimens to Enhance Contrast Method Note. Bruker-MicroCT’s Methods Notes, 70 (January): 1–8.
|
| ○ |
Cunha, M. R., Rodrigues, C. F., Génio, L., Hilário, A., Rávara, A. & Pfannkuche, O., 2013. Macrofaunal assemblages from mud volcanoes in the Gulf of Cadiz: abundance, biodiversity and diversity partitioning across spatial scales. Biogeosciences, 10: 2553–2568. https://doi.org/10.5194/bg-10-2553-2013 |
| ○ |
Dinley, J., Hawkins, L., Paterson, G., Ball, A. D., Sinclair, I., Sinnett-Jones, P. & Lanham, S., 2010. Micro-computed X-ray tomography: a new non-destructive method of assessing sectional, fly-through and 3D imaging of a soft-bodied marine worm.
Journal of Microscopy, 238: 123–133. https://doi.org/10.1111/j.1365-2818.2009.03335.x |
| ○ |
Faulwetter, S., Dailianis T., Vasileiadou, A. & Arvanitidis, C., 2013a. Contrast enhancing techniques for the application of micro-CT in marine biodiversity studies. Microscopy and analysis, 27(2): S4—S7.
|
| ○ |
Faulwetter, S., Vasileiadou, A., Kouratoras, M., Dailianis T. & Arvanitidis, C., 2013b. Micro-computed tomography: Introducing new dimensions to taxonomy. ZooKeys, 263: 1—45. https://doi.org/10.3897/zookeys.263.4261 |
| ○ |
Faulwetter, S., Dailianis T., Vasileiadou, A. & Arvanitidis, C., 2014. Can micro-CT become an essential tool for the 21st century taxonomist? An evaluation using marine polychaetes. Microscopy and analysis, 28(2): S9—S11.
|
| ○ |
Fend, S. V., Rodríguez, P., Achurra, A. & Erséus, C., 2017. On Kincaidiana Altman, 1936 and Guestphalinus Michaelsen, 1933 (Annelida, Clitellata, Lumbriculidae), with the descriptions of three new species. European Journal of Taxonomy, 361: 1–46. https://doi.org/10.5852/ejt.2017.361 |
| ○ |
Fernández, R., Kvist, S., Lenihan, J., Giribet, G. & Ziegler, A. 2014. Sine Systemate Chaos? A Versatile Tool for Earthworm Taxonomy: Non-Destructive Imaging of Freshly Fixed and Museum Specimens Using Micro-Computed Tomography. PLoS ONE, 9(5): e96617. https://doi.org/10.1371/journal.pone.0096617 |
| ○ |
Golding, R. & Jones, A., 2007. Micro-CT as a novel technique for 3D reconstruction of molluscan anatomy. Molluscan Research, 27(3): 123—128.
|
| ○ |
Heim, I. & Nickel, M., 2010. Description and molecular phylogeny of Tethya leysae sp. nov. (Porifera, Demospongiae, Hadromerida) from the Canadian Northeast Pacific with remarks on the use of microtomography in sponge taxonomy. Zootaxa, 2422: 1—21. https://doi.org/10.11646/zootaxa.2422.1.1 |
| ○ |
Holst, S., Michalik, P., Noske, M., Krieger, J. & Sötje I., 2016. Potential of X-ray micro-computed tomography for soft-bodied and gelatinous cnidarians with special emphasis on scyphozoan and cubozoan statoliths. Journal of Plankton Research, 38(5): 1225–1242. https://doi.org/10.1093/plankt/fbw054 |
| ○ |
Katzmann, W. & Laubier, L., 1974. Le genre Fauveliopsis (Polychète Sédentaire) en Méditerranée. Mikrofauna des Meeresbodens, 50: 529—542.
|
| ○ |
López, E., 2011. Occurrence of Fauveliopsis glabra (Fauveliopsidae: Annelida: Polychaeta) in a rhodolith bed off the south-eastern coast of Spain (western Mediterranean Sea).
Marine Biodiversity Records, 4: 1—4. https://doi.org/10.1017/S1755267211000418 |
| ○ |
López, E. & Martínez, J., 2018. Fauveliopsidae McIntosh, 1922. In: Annelida Polychaeta V. Parapar, J. Adarraga, I., Aguado, M.T., Aguirrezabalaga, F., Arias, A., Besteiro, C., Bleidorn, C., Capa, M., Capaccioni-Azzati, R., El-Haddad, M., Fernández-Alamo, M.A., López, E., Martínez, J., Martínez-Ansemil, E., Moreira, J., Núñez, J. & Ravara, A. Fauna Ibérica, vol. 45. M. A. Ramos et al. (eds.). Museo Nacional de Ciencias Naturales, CSIC. Madrid: 304—316.
|
| ○ |
Magalhaes, W. F., Bailey-Brock, J. H. & Rizzo, A. E., 2014. Laubieriopsis petersenae n. sp. and L. cf. cabiochi (Amoureux, 1982) (Polychaeta: Fauveliopsidae) from dredge disposal sites off Honolulu, Hawaii. Zootaxa, 3893(1): 143–150. https://doi.org/10.11646/zootaxa.3893.1.7 |
| ○ |
Marcondes Machado, M., Dias Passos, F. & Giribet, G., 2019. The use of micro-computed tomography as a minimally invasive tool for anatomical study of bivalves (Mollusca: Bivalvia). Zoological Journal of the Linnean Society, 186(1): 46–75. https://doi.org/10.1093/zoolinnean/zly054 |
| ○ |
Meiβner, K., Fiorentino, D., Schnurr, S., Martínez-Arbizu, P., Huetmann, F., Holst, S., Brix, S. & Svavarsson, J., 2014. Distribution of benthic marine invertebrates at northern latitudes – An evaluation applying multi-algorithm species distribution models.
Journal of Sea Research 85: 241–254. https://doi.org/10.1016/j.seares.2013.05.007 |
| ○ |
Metscher, B.D., 2009a. MicroCT for comparative morphology: simple staining methods allow high-contrast 3D imaging of diverse non-mineralized animal tissues. BMC Physiology, 9: 11. https://doi.org/10.1186/1472-6793-9-11 |
| ○ |
Metscher, B.D., 2009b. MicroCT for Developmental Biology: A Versatile Tool for High-Contrast 3D Imaging at Histological Resolutions.
Developmental Dynamics, 238(3): 632–640. https://doi.org/10.1002/dvdy.21857 |
| ○ |
Núñez, J., Ocaña, O. & Brito, M.C., 1997. Two new species (Polychaeta: Fauveliopsidae and Nerillidae) and other polychaetes from the marine lagoon cave of Jameos de Agua, Lanzarote (Canary Islands). Bulletin of Marine Science, 60(2): 252—260.
|
| ○ |
Parapar, J., Candás, M., Cunha-Veira, X. & Moreira, J., 2017. Exploring annelid anatomy using micro-omputed tomography:
A taxonomic approach. Zoologischer Anzeiger, 270: 19–42. https://doi.org/10.1016/j.jcz.2017.09.001 |
| ○ |
Parapar, J. & Hutchings, P., 2014. Redescription of Terebellides stroemii (Polychaeta, Trichobranchidae) and designation of a neotype. Journal of the Marine Biological Association of the United Kingdom, 95: 323–337. https://doi.org/10.1017/S0025315414000903 |
| ○ |
Parapar, J., Moreira, J., Gil, J. & Martin, D., 2016. A new species of the genus Terebellides (Polychaeta, Trichobranchidae) from the Iranian coast. Zootaxa, 4117: 321–340. https://doi.org/10.11646/zootaxa.4117.3.2 |
| ○ |
Parapar, J., Moreira, J. & Helgason, G. V., 2015a. First record of genus Orbiniella Day, 1954 (Polychaeta: Orbiniidae) in North Atlantic Ocean with the description of a new species. Zootaxa, 4006: 330–346. https://doi.org/10.11646/zootaxa.4006.2.5 |
| ○ |
Parapar, J., Moreira, J. & O’Reilly, M., 2015b. A new species of Terebellides (Polychaeta: Trichobranchidae) from Scottish waters with an insight into branchial morphology. Marine Biodiversity, 46: 211–225. https://doi.org/10.1007/s12526-015-0353-5 |
| ○ |
Parapar, J., Zhadan, A., Tzetlin, A., Vortsepneva, E. & Moreira, J., 2018a. Exploring the anatomy of Cossura pygodactylata Jones, 1956 (Annelida, Cossuridae) using micro-computed tomography, with special emphasis on gut architecture. Marine Biodiversity, 48: 751—761. https://doi.org/10.1007/s12526-018-0873-x |
| ○ |
Parapar, J., Kongsrud, J.A., Kongshavn, K., Alvestad, T., Aneiros, F. & Moreira, J., 2018b. A new species of Ampharete (Annelida: Ampharetidae) from the NW Iberian Peninsula, with a synoptic table comparing NE Atlantic species of the genus.
Zoological Journal of the Linnean Society, 183: 526—555. https://doi.org/10.1093/zoolinnean/zlx077 |
| ○ |
Parapar, J., Caramelo, C., Candás, M., Cunha-Veira, X. & Moreira, J. 2019. An integrative approach to the anatomy of Syllis gracilis Grube, 1840 (Annelida) using micro-computed X-ray tomography. PeerJ, 7: e7251. https://doi.org/10.7717/peerj.7251 |
| ○ |
Paterson, G., Sykes, D., Faulwetter, S., Merk, R., Ahmed, F., Hawkins, L., Dinley, J., Ball, A. & Arvanitidis, C., 2014. The pros and cons of using micro-computed tomography in gross and micro-anatomical assessments of polychaetous annelids. Memoirs of Museum Victoria, 71: 237—246. https://doi.org/10.24199/j.mmv.2014.71.18 |
| ○ |
Pedrouzo, L., Cobo, M. C., García-Álvarez, O., Rueda, J. L., Gofas, S. & Urgorri, V., 2014. Solenogastres (-Mollusca) from expeditions off the South Iberian Peninsula, with the description of a new species. Journal of Natural History, 48: 2985—3003. https://doi.org/10.1080/00222933.2014.959576 |
| ○ |
Petersen, M. E., 2000. A new genus of Fauveliopsidae (Annelida; Polychaeta), with a review of ITS species and redescription of some described taxa. Bulletin of Marine Science, 67(1): 491—515.
|
| ○ |
Purschke, G., 2011. Sipunculid-like ocellar tubes in a polychaete, Fauveliopsis cf. adriatica (Annelida, Fauveliopsidae): implications for eye evolution. Invertebrate Biology, 130(2): 115–128. https://doi.org/10.1111/j.1744-7410.2011.00226.x |
| ○ |
Riser, N. W., 1987. A new interstitial polychaete (Family Fauveliopsidae) from the shallow subtidal of New Zealand with observations on related species. Bulletin of the Biological Society of Washington, 7: 211—216.
|
| ○ |
Rouse, G. W., 2001a. Family Fauveliopsidae. In: P.L. Beesley, G.J.B. Ross & C.J. Glasby (eds.). Polychaetes & Allies: The Southern Synthesis. Fauna of Australia. 4A. Polychaeta, Myzostomida, Pogonophora, Echiura, Sipuncula. CSIRO Publishing. Melbourne: 220—222.
|
| ○ |
Rouse, G. W., 2001b. Morphology & Physiology. In: P.L. Beesley, G.J.B. Ross & C.J. Glasby (eds.). Polychaetes & Allies: The Southern Synthesis. Fauna of Australia. 4A. Polychaeta, Myzostomida, Pogonophora, Echiura, Sipuncula. CSIRO Publishing. Melbourne: 9—32.
|
| ○ |
Rouse, G. W. & Pleijel, F., 2001. Polychaete anatomy. In: G.W. Rouse & F. Pleijel (eds.). Polychaetes. Oxford University Press. Oxford: 18—35.
|
| ○ |
Sombke, A., Lipke, E., Michalik, P., Uhl, G. & Harzsch, S., 2015. Potential and limitations of X-Ray Micro-Computed Tomography in Arthropod neuroanatomy: A methodological and comparative survey. The Journal of Comparative Neurology, 523: 1281–1295. https://doi.org/10.1002/cne.23741 |
| ○ |
Thiel, D., Purschke, G. & Böggemann, M., 2011. Abyssal Fauveliopsidae (Annelida) from the South East Atlantic. Journal of Natural History, 45: 923—937. https://doi.org/10.1080/00222933.2010.540046 |
| ○ |
Zhadan, A. & Atroshchenko, M., 2010. The Morphology of Laubieriopsis sp. (Polychaeta, Fauveliopsidae) and the Position of Fauveliopsids in the Polychaete System. Biology Bulletin, 37(9): 876—885. https://doi.org/10.1134/S1062359010090025 |
| ○ |
Zhadan, A. & Atroshchenko, M., 2012. A new species of Fauveliopsidae (Annelida) from the North Sea. ZooKeys, 181: 1—10. https://doi.org/10.3897/zookeys.181.2712 |
| ○ |
Zhadan, A. & Salazar-Vallejo, S., 2014. Fauveliopsidae Hartman, 1971. In: A. Schmidt-Rhaesa (Ed.). Handbook of Zoology Online. Annelida. Polychaetes. De Gruyter: 1—11.
|
| ○ |
Zhadan, A., Vortsepneva, E. & Tzetlin, A., 2014. Three-dimensional reconstruction of the musculature of Cossura pygodactylata Jones, 1956 (Annelida: Cossuridae). Zoologischer Anzeiger, 253: 181–191. https://doi.org/10.1016/j.jcz.2013.12.005 |
Fig. 1.— Laubieriopsis cabiochi. MNCN 16.01/18543. Imágenes al microscopio estereoscópico de la anatomía externa de tres ejemplares no tratados. A, aspecto general de los ejemplares; B, vista dorsal de la región anterior y media; C, detalle de la región anterior; D, extremo posterior; E, región media. Abreviaturas en el texto.