ESTUDIO DEL CRÁNEO MEDIANTE MORFOMETRÍA GEOMÉTRICA EN DOS ESPECIES DE SYLVILAGUS GRAY, 1867 (MAMMALIA: LAGOMORPHA)
Pere M. Parés-Casanova
Departament de Ciència Animal, Universitat de Lleida, Av. Rovira Roure 191, 25198 Lleida, Cataluña (España).
E-mail: peremiquelp@ca.udl.cat – http://orcid.org/0000-0003-1440-6418
| |
RESUMEN
Dentro del género Sylvilagus Gray, 1867 se reconocen, entre otras, las especies Sylvilagus brasiliensis (Linnaeus, 1758) y Sylvilagus floridanus (J.A. Allen, 1890) los estudios morfológicos disponibles de las cuales son muy extensos. Por ello, se realizó un estudio comparativo de la conformación craneal en ambas especies empleando técnicas de morfometría geométrica. Para ello se estudió un total de 31 cráneos de S. brasiliensis y 16 S. floridanus en los que, a partir de las fotografías, se situaron 12 hitos anatómicos en el plano dorsal. No aparecieron diferencias entre sexos pero sí entre especies, tanto en tamaño como en forma, presentando S. brasiliensis un cráneo de menor longitud pero más ancho que S. floridanus. Al tratarse de puntos no especialmente importantes de inserción muscular, ni albergar externamente estructuras funcionales importantes (como podría ser todo lo relacionado con la visión), y en vista de los requerimientos ecológicos similares para ambas especies estudiadas, se interpreta que las diferencias detectadas son debidas a un mero cambio derivado de la diferencia de tamaño entre las dos especies –S. brasiliensis es de menor tamaño que S. floridanus-. Dicho de otro modo: la reducción del tamaño craneal no implicaría una mera versión reducida de la forma (una “reducción harmónica”), sino que exigiría cambios heterotópicos, un rediseño estructural derivado de la reducción en tamaño. Suponemos que estas diferencias regionales en la estructura craneal son más debidas a cambios en los patrones de desarrollo que a una diferencia en las estrategias de vida para ambas especies, a la vista de los requerimientos ecológicos similares entra ambas especies estudiadas.
Palabras clave: alometría; conejo de Virginia; S. brasiliensis; S. floridanus; tapetí.
|
| |
ABSTRACT
Skull geometric morphometric analysis among two cottontail rabbits Sylvilagus Gray, 1867 (Mammalia: Lagomorpha)
Within the genus Sylvilagus Gray, 1867, Sylvilagus brasiliensis (Linnaeus, 1758) and Sylvilagus floridanus (J.A. Allen, 1890) are some of its recognized species, for whom morphological studies in both species are extensive. Therefore, a comparative study was conducted between the cranial conformation using techniques of geometric morphometrics. For this purpose we studied a total of 31 S. brasiliensis and 16 S. floridanus skulls. Pictures were obtained and 12 anatomical landmarks were situated on the dorsal aspect. There did not appear differences between sexes but indeed between both species, both in size and shape. S. brasiliensis presented a shorter but wider the skull of than S. floridanus. Anatomical points were not particularly important as muscular attachments neither host externally important functional structures (as it might be those related to the view); due to this fact and that both species share similar ecological requirements it is plausible to think that detected differences were merely due to changes derived from the size differences –S. brasiliensis is smaller than S. floridanus-. In other words: the cranial size reduction would not imply a mere reduced form version (a “harmonic reduction”), but it would require heterotopic changes, e.g. a redesign structural derivative of the size reduction. We assume these regional differences in cranial structure to be due more to changes in development patterns between both species rather than a difference in their life strategies, in view of the similar ecological requirements for both.
Key words: allometry; Eastern cottontail; S. brasiliensis; S. floridanus; tapeti.
|
IntroducciónTOP
Son principios mecánicos simples los que predicen cambios en la forma cuando dos especies animales difieren notablemente en su tamaño (Swiderski, 2003). Pero las comparaciones de la forma entre especies, si están basadas solamente en el análisis de las diferencias de sus dimensiones lineales, aun pudiendo ser detalladamente descritas, no permiten ser analizadas cuantitativamente (Toro Ibacache et al., 2010). En morfometría geométrica (MG), es posible tanto la cuantificación de la forma como la visualización de los cambios morfológicos (Bookstein, 1992; Adams, 1999; Rohlf, 2005; Toro Ibacache et al., 2010). Por ello, el análisis con MG permite realizar interpretaciones de alto significado biológico, de diferencias entre individuos, de diferencias entre poblaciones, etc. (Bookstein, 1992; Rohlf, 2005; Toro Ibacache et al., 2010).
La MG ha sido empleada en el campo de la taxonomía y filogenia de vertebrados, y utilizada en estructuras morfológicas óseas muy diferentes. Para el estudio de mamíferos colombianos, se conocen algunos trabajos que recurren a la MG para determinar variaciones intra e interespecíficas y establecer relaciones filogenéticas. Pero no es el caso del género Sylvilagus Gray, 1867, en el que la mayoría de estudios morfológicos se han basado en morfometría lineal o “clásica” (Castañeda et al., 2015; Diersing & Wilson, 2017) (aunque estos últimos se equivocaron estrepitosamente en su taxonomía).
Taxonómicamente el género Sylvilagus (conejos conocidos vernáculamente “de rabo blanco” o “pequeñas liebres”), pertenece al orden Lagomorpha, e incluye 13 especies (Castañeda et al., 2015), todas ellas de distribución americana (Chapman et al., 1990). Dentro del género, se reconocen entre otras las especies S. brasiliensis (Linnaeus, 1758) y S. floridanus (J.A. Allen, 1890) (Chapman et al., 1990). Sylvilagus brasiliensis adulto pesa en promedio 0,9-1,8 kg y mide 35-43 cm de largo (De Barba, 2015), mientras que el adulto de S. floridanus es mayor, pesando en promedio 1,2 kg y midiendo 43 cm de largo (Orr, 1940; Bond et al., 2004).
Partiendo de una colección osteológica existente del género Sylvilagus centrada en el tapetí (S. brasiliensis) –también conocido como conejo brasileño, conejo de páramo, conejo muleto, conejo del bosque o mulita de monte-, y en el conejo de Virginia (S. floridanus), se realizó un estudio comparativo entre la conformación craneal de ambas especies empleando técnicas de MG. Al comparar morfométricamente estas dos especies entre sí, formas y tamaños craneales, cualquiera que sea la magnitud de sus diferencias, serán un indicador de: 1) un cambio en tamaño que todavía permite la presencia de su notable similitud fenotípica, y 2) las consecuentes diferencias en forma, como producto de la modificación en tamaño corporal. Por lo tanto, el objetivo de este trabajo es conocer cuáles son esas diferencias morfométricas entre ambas especies.
Material y métodosTOP
MuestreoTOP
Los especímenes examinados en este estudio procedían de la colección mastológica del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia. Las muestras incluyeron en total 47 cráneos Sylvilagus (31 S. brasiliensis, 16 ♂♂, 13 ♀♀ y 2 de sexo no registrado) y 16 S. floridanus (6 ♂♂, 7 ♀&♀ y 3 de sexo no registrado). La clasificación de los 47 especímenes se basó según la identificación a nivel de especie en el catálogo, que no contenía información sobre la edad. La información individual de los especímenes estudiados puede requerirse al autor. Con el objetivo de minimizar el error en las escalas, todos los cráneos fueron fotografiados siempre por el propio autor, estableciéndose un protocolo estándar para la toma de las imágenes (uso de una escala en cada foto, calibración de luz proveniente de la cámara, abertura y velocidad de disparo controlados) (Parés-Casanova, 2013; Samuel et al., 2015).
Obtención de datosTOP
Se obtuvieron imágenes digitales, en el plano dorsal de cada cráneo, mediante una cámara digital Nikon D1500 equipada con una lente 40 mm 1:2.8G MicroNikkor. Cada espécimen se colocaba previamente en el centro del campo óptico, con su cara dorsal orientada paralelamente a la cámara. A fin de eliminar distorsiones de las posiciones relativas de los ángulos debido a un efecto parallax –de profundidad- (Webster & Sheets, 2010), la cámara se situó a suficiente distancia para asegurar que el cráneo ocupara únicamente una parte del campo visual, libre de distorsiones. El no tener en cuenta el criterio de coplanaridad podría provocar una interpretación errónea de resultados, dado que pueden existir variaciones importantes de la forma no apreciables en el plano paralelo a la toma fotográfica (Toro Ibacache et al., 2010). Se incluyó en cada toma un patrón milimétrico a fin de establecer la longitud cefálica real.
Las imágenes fueron almacenadas en extensión .jpg de 9.3 Mb de promedio y posteriormente se transfirieron al computador. Se situaron 12 hitos anatómicos en cada espécimen (Fig. 1), basados parcialmente en estudios previos (Ge et al., 2015; Parés-Casanova et al., 2018), y definidos como:
|
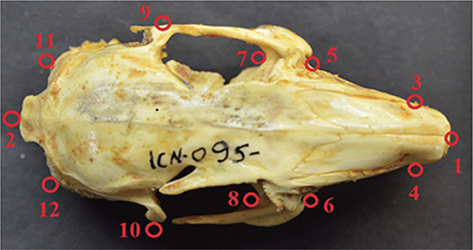 Fig. 1.— Hitos (12) utilizados para el estudio de los cráneos de Sylvilagus Gray, 1867 (plano dorsal). Véase el texto para una descripción detallada de cada uno de ellos. Los dos últimos, aquí no representados, fueron colocados sobre un patrón lineal a fin de establecer la longitud cefálica en mm. Fig. 1.— Hitos (12) utilizados para el estudio de los cráneos de Sylvilagus Gray, 1867 (plano dorsal). Véase el texto para una descripción detallada de cada uno de ellos. Los dos últimos, aquí no representados, fueron colocados sobre un patrón lineal a fin de establecer la longitud cefálica en mm.
Fig. 1.— Landmarks (12) used to study skulls of Sylvilagus Gray, 1867 (dorsal aspect). See text for detailed references. Last two landmarks (not showed here) were located on a lineal ruler in order to obtain cephalic length in mm.
|
|
| 1. |
El punto más oro-distal del cráneo, sobre el hueso incisivo |
| 2. |
El punto más caudal del cráneo, sobre el hueso occipital |
| 3. |
Lado izquierdo de la sutura maxilo-incisiva |
| 4. |
Lado derecho de la sutura maxilo-incisiva |
| 5. |
Lado izquierdo de la escotadura cigomática |
| 6. |
Lado derecho de la escotadura cigomática |
| 7. |
Escotadura lacrimal de la cuenca orbitaria izquierda |
| 8. |
Escotadura lacrimal de la cuenca orbitaria derecha |
| 9. |
Punto más lateral del arco cigomático izquierdo |
| 10. |
Punto más lateral del arco cigomático derecho |
| 11. |
Sutura témporo-parietal izquierda |
| 12. |
Sutura témporo-parietal derecha |
Todos los puntos craneométricos considerados corresponden a puntos definidos a partir de referentes anatómicos homólogos y repetibles, se consideraron suficientes para reflejar la morfología en su cara dorsal del neurocráneo y del viscerocráneo, y fueron situados en cada espécimen mediante el programa TpsDig versión 1.40 (Rohlf, 2010).
Los hitos seleccionados generaron una matriz de coordenadas (X e Y) que representan las configuraciones geométricas del cráneo por espécimen. La matriz de configuraciones de coordenadas fue sometida a un Análisis Generalizado de Procrustes, donde la variación asociada a los efectos de posición, orientación y escala fue eliminada mediante una superposición Procrustes, usando la estimación de los mínimos cuadrados (Bookstein, 1992; Adams, 1999). En líneas generales este análisis consta de tres pasos iterativos: 1) cada configuración se centra en el origen del sistema de coordenadas y luego se ajusta a una unidad de tamaño común; 2) las configuraciones escaladas se trasladan unas sobre otras sobreponiéndose, de tal modo que coincidan sus centros de gravedad (centroides); y 3) se rotan hasta minimizar las distancias entre cada hito y una configuración promedio, utilizando el criterio matemático de los mínimos cuadrados (Zelditch et al., 2004; Savriama et al., 2010; Toro Ibacache et al., 2010).
La correlación de la forma de los especímenes con el espacio tangente -en el que las configuraciones son proyectadas de manera ortogonal- (Toro Ibacache et al., 2010) se analizó con el programa TpsSmall versión 1.33 (Rohlf, 2010).
Análisis de las diferencias entre longitudes cranealesTOP
A partir del patrón utilizado en cada fotografía se obtuvo la longitud craneal, expresada en mm, del cráneo, entendida como la distancia de los hitos 1 a 2. La comparación de las longitudes entre ambas especies se realizó con un test U de Mann Whitney. Se obtuvo así mismo el valor F el test de Goodall a fin de evaluar la distancia entre ambos grupos (Bookstein, 1992).
Análisis de la formaTOP
A fin de evitar distorsiones producidas por una posible asimetría bilateral, y aunque no se detectó asimetría fluctuante entre el hemicráneo derecho e izquierdo (analizada mediante un ANOVA de dos vías, en la que se consideró la interacción “individuo*lado” como asimetría fluctuante (Klingenberg, 2015) y que reflejó un valor p = 0,860), se trabajó con el promedio de las coordenadas Procrustes de los lados izquierdo y derecho reflejados especularmente.
Las diferencias en la forma fueron analizadas con un test NPMANOVA (“Non Parametric Multivariate ANalysis Of VAriance”), utilizando el de dos vías para detectar posibles diferencias entre sexos (los 5 especímenes no sexados fueron excluidos) y entre especies, recurriendo al uso de la distancia euclideana entre coordenadas Procrustes y aplicando 9.999 permutaciones y un test F de Goodall posterior (Bookstein, 1992). La alometría se interpretó como en cambio de la forma en relación al tamaño (o sea, como la regresión de las coordenadas Procrustes versus el tamaño del centroide, logarítmicamente transformado) (Mosimann, 1970; Savriama et al., 2010; Klingenberg, 2016).
Análisis de Componentes PrincipalesTOP
Se realizó finalmente un Análisis de Componentes Principales (ACP) a partir de la matriz de varianza-covarianza (Bookstein, 1992), a fin de detectar las variables anatómicas que explicaban más las diferencias entre especies. Se utilizaron además mallas de deformación (Zelditch et al., 2004) para analizar los cambios de forma, en los ejemplares más extremos. A fin de eliminar el efecto alométrico se procedió finalmente a un segundo NPMANOVA utilizando los valores de cada espécimen en cada uno de los componentes principales (Savriama et al., 2010).
La obtención de las coordenadas Procrustes y tamaño de centroide se realizó con el programa MorphoJ (Klingenberg, 2011). Con la herramienta TpsRelWarp versión 1.63 (Rohlf, 2010) se obtuvieron las variables del cambio uniforme en X e Y. El resto de análisis se efectuó con el programa PAST versión 2.17c (Hammer et al., 2001). El nivel de significación se estableció en el 5%.
ResultadosTOP
Correlación entre la forma y el espacio tangenteTOP
El valor de la correlación (0,999) indicó que las inferencias sobre la forma de éstas especies estudiadas pueden ser analizadas en el espacio lineal tangente, lo que nos permitió el uso de la aproximación del plano en los análisis estadísticos siguientes.
Forma y tamañoTOP
El análisis NPMANOVA (del que se excluyeron los especímenes sin sexo registrado) reflejó la ausencia de diferencias entre sexos (p = 0,504) pero la presencia de diferencias estadísticamente significativas entre especies (p = 0,009) (Tabla 1). Para los análisis posteriores, pues, se agruparon los cráneos sin diferenciar por sexo. El test F de Goodall presentó un valor sin diferencias significativas (F20,900 = 0,939; p = 0,536), de lo que se deduce que las distancias Procrustes entre la forma de referencia y la forma objetivo presentaban valores bajos. El test de Mann Whitney demostró una diferencia estadísticamente significativa para la longitud craneal entre ambas especies (U = 60, p << 0,0001) (Fig. 2). Para ambas especies, la alometría era significativa (p < 0,001) (Fig. 3).
Tabla 1.— Análisis NPMANOVA de dos vías. El análisis reflejó la ausencia de diferencias entre sexos (p = 0,504) pero aparecieron diferencias estadísticamente significativas entre especies (p = 0,009).
Table 1.— Two-way NPMANOVA. This analysis reflected no differences between sexes (p = 0.504), but there appeared statistically significative differences between species (p = 0.009).
| Factor |
Suma de cuadrados |
Grados de libertad |
Promedio cuadrado |
F |
P |
| Especie |
0,00939 |
1 |
0,00939 |
3,4358 |
0,009 |
| Sexo |
0,00167 |
1 |
0,00167 |
0,6107 |
0,504 |
| Interacción |
-0,02255 |
1 |
-0,02255 |
-8,2475 |
0,889 |
| Residual |
0,10389 |
38 |
0,00273 |
|
|
| Total |
0,09240 |
41 |
|
|
|
|
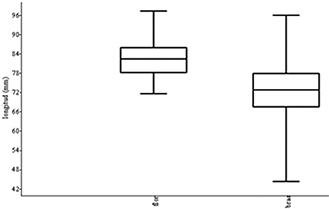 Fig. 2.— “Box plot” para las longitudes craneales de S. floridanus (J.A. Allen, 1890) (flor) (n = 16) y S. brasiliensis (Linnaeus, 1758) (bras) (n = 31). El test de Mann Whitney demostró una diferencia estadísticamente significativa entre ambas especies (U = 60, p << 0,0001). Fig. 2.— “Box plot” para las longitudes craneales de S. floridanus (J.A. Allen, 1890) (flor) (n = 16) y S. brasiliensis (Linnaeus, 1758) (bras) (n = 31). El test de Mann Whitney demostró una diferencia estadísticamente significativa entre ambas especies (U = 60, p << 0,0001).
Fig. 2.— Box plot for skull length of S. floridanus (J.A. Allen, 1890) (flor) (n = 16) and S. brasiliensis (Linnaeus, 1758) (bras) (n = 31). Mann Witney test showed an statistically significative difference between both species (U = 60, p << 0.0001).
|
|
|
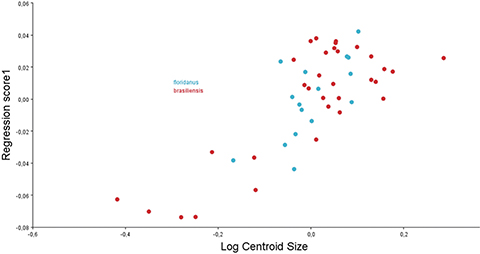 Fig. 3.— Regresión de las coordenadas Procrustes versus el tamaño del centroide, logarítmicamente transformado para S. floridanus (J.A. Allen, 1890) (flor) (n = 16) y S. brasiliensis (Linnaeus, 1758) (bras) (n = 31). Para ambas especies la regresión fue estadísticamente significativa (p < 0,001). Fig. 3.— Regresión de las coordenadas Procrustes versus el tamaño del centroide, logarítmicamente transformado para S. floridanus (J.A. Allen, 1890) (flor) (n = 16) y S. brasiliensis (Linnaeus, 1758) (bras) (n = 31). Para ambas especies la regresión fue estadísticamente significativa (p < 0,001).
Fig. 3.— Procrustes coordinates regression against centroid size (values log-transformed), for S. floridanus (J.A. Allen, 1890) (flor) (n = 16) and S. brasiliensis (Linnaeus, 1758) (bras) (n = 31). Regression was statistically significative for both species (p < 0,001).
|
|
PCA y patrones de deformaciónTOP
Los dos primeros componentes principales explicaron un 68,57% de la varianza total observada (PC1 + PC2 = 52,36 + 16,21 %)
(Tabla 2), apareciendo los hitos faciales (X1, X2, X3) y los de la bóveda craneal (X e Y11, X e Y12) como los más discriminantes (Fig. 4). O sea, que tanto los hitos situados en el esplacnocráneo como en el neurocráneo contribuyeron a la diferenciación entre especies. Se aprecia que la trayectoria del cambio de cada vector a nivel de la cara se dirige longitudinalmente, es decir, rostral o caudal, y por otra parte, los puntos neurocraneales de ambos lados tienden principalmente de manera transversal, es decir, la mayor variación captada se localiza en el tercio distal de la cara y en la porción lateral de la calvaria (Fig. 5), lo que se atribuye mayoritariamente a diferencias en longitud facial (mayor en S. floridanus) y anchura neurocraneal (mayor en S. brasiliensis) (Fig. 6). O sea, que la tendencia con el aumento de tamaño es hacia una expansión facial y una contracción de la calvaria (Fig. 7).
Tabla 2.— Resultados del Análisis de Componentes Principales para los 10 primeros componentes principales. Los dos primeros componentes principales explicaron un 68,57% de la varianza total observada (PC1 + PC2 = 52,36 + 16,21 %).
Table 2.— Results of Principal Component Analysis to first 10 principal components. First two principal component explained a 68.57 % of total observed variance (PC1 + PC2 = 52.36 + 16.21 %).
| Componente principal |
Eigenvalor |
% varianza |
% varianza acumulada |
| 1 |
0,001153 |
52,360 |
52,360 |
| 2 |
0,000357 |
16,214 |
68,574 |
| 3 |
0,000240 |
10,875 |
79,449 |
| 4 |
0,000124 |
5,616 |
85,065 |
| 5 |
0,000117 |
5,310 |
90,375 |
| 6 |
7,91E-05 |
3,591 |
93,967 |
| 7 |
5,83E-05 |
2,647 |
96,614 |
| 8 |
3,00E-05 |
1,363 |
97,977 |
| 9 |
2,47E-05 |
1,120 |
99,098 |
| 10 |
1,99E-05 |
0,901 |
100 |
|
 Fig. 4.— Variación de cada uno de los puntos craneométricos visualizada en norma dorsal. Gráfica consenso con el modo de vectores no deformados a partir de 12 puntos craneométricos. Dispersión sin magnificar. Fig. 4.— Variación de cada uno de los puntos craneométricos visualizada en norma dorsal. Gráfica consenso con el modo de vectores no deformados a partir de 12 puntos craneométricos. Dispersión sin magnificar.
Fig. 4.— Variation for each skull landmark on the dorsal aspect. Consensus plot with non-deformed vectors mode. Non-magnified dispersion.
|
|
|
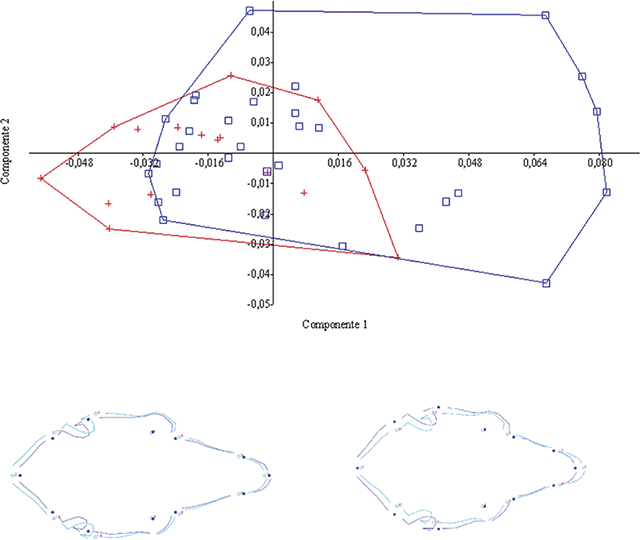 Fig. 5.— Análisis de Componentes Principales para los dos primeros componentes principales, que explicaron un 68,57 % de la varianza total observada (PC1 + PC2 = 52,36 + 16,21 %). Cuadrados: S. brasiliensis (Linnaeus, 1758) (n = 31), cruces: S. floridanus (J.A. Allen, 1890) (n = 16). Los hitos situados en la bóveda craneal (9, 10 y 11) fueron los que más diferencias presentaron entre especies. Silvilagus floridanus tendió a presentar un alargamiento de la bóveda. En la imagen inferior, se visualizan los cambios de contorno respecto de la forma promedio (trazo débil) al pasar de S. floridanus (a la izquierda, valores negativos del CP1) a S. brasiliensis (a la derecha, valores positivos del CP1). Obsérvese el acortamiento facial de S. brasiliensis, pero una mayor anchura craneal en comparación a S. floridanus. Fig. 5.— Análisis de Componentes Principales para los dos primeros componentes principales, que explicaron un 68,57 % de la varianza total observada (PC1 + PC2 = 52,36 + 16,21 %). Cuadrados: S. brasiliensis (Linnaeus, 1758) (n = 31), cruces: S. floridanus (J.A. Allen, 1890) (n = 16). Los hitos situados en la bóveda craneal (9, 10 y 11) fueron los que más diferencias presentaron entre especies. Silvilagus floridanus tendió a presentar un alargamiento de la bóveda. En la imagen inferior, se visualizan los cambios de contorno respecto de la forma promedio (trazo débil) al pasar de S. floridanus (a la izquierda, valores negativos del CP1) a S. brasiliensis (a la derecha, valores positivos del CP1). Obsérvese el acortamiento facial de S. brasiliensis, pero una mayor anchura craneal en comparación a S. floridanus.
Fig. 5.— Principal Component Analysis for 2 first principal components which explained a 68.57 % of total observed variance (PC1 + PC2 = 52.36 + 16.21 %). Squares: S. brasiliensis (Linnaeus, 1758) (n = 31), crosses: S. floridanus (J.A. Allen, 1890) (n = 16). Landmarks on skull vault (9, 10 and 11) showed highest differences between species. Silvilagus floridanus tended to present a longer vault. Lower picture: changes of contour against average form (faint line) for S. floridanus (left, negative values of PC1) and S. brasiliensis (right, positive values of PC1). Note the face shortening and a wider skull width of S. brasiliensis relative to S. floridanus.
|
|
|
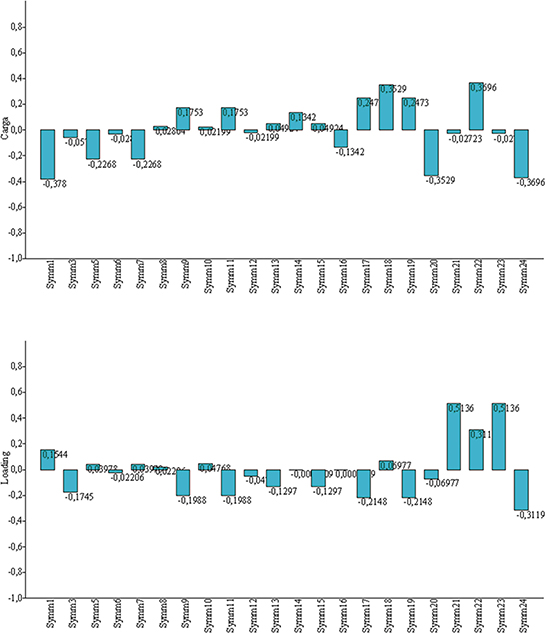 Fig. 6.— Descarga de valores en el Análisis de Componentes Principales para los dos primeros componentes principales, que explicaron un 68,57 % de la varianza total observada (PC1 + PC2 = 52,36 + 16,21 %). Tanto los hitos situados en el esplacnocráneo (X1, X2, X3) como en el neurocráneo (X e Y11, X e Y12) fueron los que contribuyeron mayoritariamente a explicar la varianza observada. Fig. 6.— Descarga de valores en el Análisis de Componentes Principales para los dos primeros componentes principales, que explicaron un 68,57 % de la varianza total observada (PC1 + PC2 = 52,36 + 16,21 %). Tanto los hitos situados en el esplacnocráneo (X1, X2, X3) como en el neurocráneo (X e Y11, X e Y12) fueron los que contribuyeron mayoritariamente a explicar la varianza observada.
Fig. 6.— Loadings for two first principal components in Principal Component Analysis, which explained a 68.57 % of the total observed variance (PC1 + PC2 = 52.36 + 16.21 %). Landmarks of splanchnocranium (X1, X2, X3) as well as on neurocranium (X e Y11, X, Y12) contributed mostly to observed variance.
|
|
|
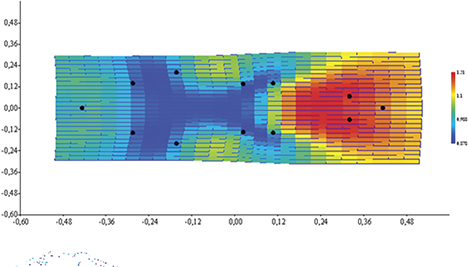 Fig. 7.— Rejilla de transformación TPS para el ejemplar más grande de Sylvilagus brasiliensis (Linnaeus, 1758). Se observa la tendencia hacia una expansión facial (coloración rojiza) y una contracción de la calvaria (coloración azulácea), o sea, hacia una forma más próxima a la de S. floridanus (J.A. Allen, 1890), especie de mayor tamaño. En la imagen inferior, se visualizan los cambios de contorno respecto de la forma promedio (trazo débil). Fig. 7.— Rejilla de transformación TPS para el ejemplar más grande de Sylvilagus brasiliensis (Linnaeus, 1758). Se observa la tendencia hacia una expansión facial (coloración rojiza) y una contracción de la calvaria (coloración azulácea), o sea, hacia una forma más próxima a la de S. floridanus (J.A. Allen, 1890), especie de mayor tamaño. En la imagen inferior, se visualizan los cambios de contorno respecto de la forma promedio (trazo débil).
Fig. 7.— TPS transformation grid for the biggest specimen of Sylvilagus brasiliensis (Linnaeus, 1758). It can be observed a tendency towards a face expansion (reddish colour) and a calvaria contraction (bluish coloration), e.g. towards a form closer to S. floridanus (J.A. Allen, 1890), which is a bigger species. On lower picture, contour changes against average form (faint line) are showed.
|
|
En el nuevo NPMANOVA utilizando los valores de cada espécimen en cada uno de los componentes principales, siguen manifestándose diferencias entre especies (p = 0,0078) pero no entre sexos (p = 0,599).
DiscusiónTOP
Nuestro estudio basado en análisis morfogeométricos del cráneo de S. floridanus y S. brasiliensis no demuestra la existencia de diferencias a nivel craneal (plano dorsal) entre sexos, lo que coincide con la bibliografía consultada (Ge et al., 2015), o bien, aunque descrita por otros autores (Chapman et al., 1990), sin llegar a manifestarse geométricamente a nivel craneal, sino en otras partes del cuerpo. Pero sí que aparecen diferencias entre las dos especies estudiadas, tanto de tamaño como de forma, presentando S. brasiliensis un cráneo de menor longitud que S. floridanus –algo lógico si se atiende al menor peso corporal y longitud corporal de esta última especie-, y siendo aquel más corto de cara y más ancho de bóveda. Al tratarse de estructuras no especialmente importantes de inserción muscular, ni albergar externamente estructuras funcionales (como podría ser todo lo relacionado con la vista) (Spataru et al., 2013; Watson et al., 2014), y vistos los requerimientos ecológicos similares para ambas especies estudiadas (Castañeda et al., 2015), este estudio sugiere que esta variación de la forma entre especies podría tratarse de un mero cambio derivado de la diferencia de tamaño. Dicho de otro modo: una reducción del tamaño craneal no implicaría una versión reducida de la forma (una “reducción harmónica”), sino que se expresaría como un cambio heterotópico, cambios diferentes en cada punto de toda la estructura cefálica. Esta heterocronía, que produce diferencias en el desarrollo postanatal entre especies, ha sido ampliamente descrita en el cráneo (Cordeiro-Estrela et al., 2006; Cardini & Polly, 2013), asociándose claramente este cambio, en algunas ocasiones, a diferencias funcionales (Del Castillo et al., 2016).
Este estudio taxonómico se basa en relativamente pocos ejemplares, y centrado únicamente en el plano dorsal craneal. El estudio en otras proyecciones probablemente permitiría extraer más conclusiones a nivel anatómico-funcional e incluso llegar a determinar una fórmula de discriminación entre ambas especies.
AgradecimientosTOP
El autor agradece encarecidamente las facilidades ofrecidas por Catalina Cárdenas y Hugo Fernando López al permitir el acceso a la colección del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia. Agradecimiento igualmente a los revisores anónimos por sus comentarios y sugerencias.
ReferenciasTOP
| ○ |
Adams, D. C., 1999. Methods for shape analysis of landmark data from articulated structures. Evolutionary Ecology Research, 1(8): 959–970. |
| ○ |
Barba, H. de, 2015. Presenza di Sylvilagus floridanus (J. A. Allen, 1890) nei diversi habitat del Delta del Po. Thesis. Universita degli Studi di Padova. Università degli Studi di Padova. 131 pp. |
| ○ |
Bond, B. T., Bowman, J. L., Leopold, B. D., Burger, L. W., Godwin, K. D. & Class, C. M., 2004. Demographics, morphometrics, and reproductive characteristics of Eastern Cottontails (Sylvilagus floridanus) in Mississippi. Journal of the Mississippi Academy of Sciences, 49: 2420–2424. |
| ○ |
Bookstein, F. L., 1992. Morphometric Tools for Landmark Data: Geometry and Biology. Cambridge University Press. https://doi.org/10.1017/CBO9780511573064 |
| ○ |
Cardini, A. & Polly, P. D., 2013. Larger mammals have longer faces because of size-related constraints on skull form. Nature Communications, 4: 2458. https://doi.org/10.1038/ncomms3458 |
| ○ |
Castañeda, R., Viana, C. & Buitrago, L., 2015. Caracterización de los lepóridos (Mammalia: Leporidae) del bosque seco tropical del Departamento del Tolima (Colombia). Boletín Científico. Centro de Museos. Museo de Historia Natural, 19(1): 117–124. |
| ○ |
Castillo, D. L. del, Segura, V., Flores, D. A. & Cappozzo, H. L., 2016. Cranial development and directional asymmetry in Commerson’s dolphin, Cephalorhynchus commersonii commersonii: 3D geometric morphometric approach. Journal of Mammalogy, 97(5): 1345–1354. https://doi.org/10.1093/jmammal/gyw101 |
| ○ |
Chapman, J. A., Flux, J. E. C. & Gibb, J. A., 1990. Rabbits, Hares and Pikas. Status Survey and Conservation Action Plan. International Union for Conservation of Nature and Natural Resources. Gland. International Union for Conservation of Nature and Natural Resources. 168 pp. |
| ○ |
Cordeiro-Estrela, P., Baylac, M., Denys, C. & Marinho-Filho, J., 2006. Interspecific patterns of skull variation between sympatric Brazilian Vesper Mice: geometric morphometrics assessment. Journal of Mammalogy, 87(6): 1270–1279. https://doi.org/10.1644/05-MAMM-A-293R3.1 |
| ○ |
Diersing, V. E. & Wilson, D. E., 2017. Systematic status of the rabbits Sylvilagus brasiliensis and S. sanctaemartae from northwestern South America with comparisons to Central American populations. Journal of Mammalogy, 98(6): 1641–1656. https://doi.org/10.1093/jmammal/gyx133 |
| ○ |
Ge, D., Xia, L., Yao, L., Zhang, Z. & Yang, Q., 2015. Geometric morphometric analysis of skull morphology reveals loss of phylogenetic signal at the generic level in extant lagomorphs (Mammalia: Lagomorpha). Contributions to Zoology, 84(4): 267–284. |
| ○ |
Hammer, Ø., Harper, D. A. T. & Ryan, P. D., 2001. Past: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica, 4(1): 1–9. |
| ○ |
Klingenberg, C. P., 2011. MorphoJ: An integrated software package for geometric morphometrics. Molecular Ecology Resources, 11(2): 353–357. https://doi.org/10.1111/j.1755-0998.2010.02924.x |
| ○ |
Klingenberg, C. P., 2015. Analyzing fluctuating asymmetry with geometric morphometrics: concepts, methods, and applications. Symmetry, 7: 843–934. https://doi.org/10.3390/sym7020843 |
| ○ |
Klingenberg, C. P., 2016. Size, shape, and form: concepts of allometry in geometric morphometrics. Development Genes and Evolution, 226(3): 113–137. https://doi.org/10.1007/s00427-016-0539-2 |
| ○ |
Mosimann, J. E., 1970. Size allometry: size and shape variables with characterizations of the lognormal and generalized gamma distribution. Journal of the American Statistical Association, 65(330): 930–945. |
| ○ |
Orr, R. T., 1940. The rabbits of California. Occasional Papers of Californian Academy of Sciences, 19: 1–227. |
| ○ |
Parés-Casanova, P. M., 2013. Allometric shape variation in Ovis aries mandibles: A digital morphometric analysis. Journal of Morphological Sciences, 30(4): 1–3. |
| ○ |
Parés-Casanova, P. M., Sofiane, K. & Medina, A., 2018. Diferente desarrollo cefálico según tipo de conejo. Revista de Ciencias Veterinarias, 36(2): 15–21. https://doi.org/10.15359/rcv.36-2.2 |
| ○ |
Rohlf, F. J., 2005. Geometric morphometrics simplified. Trends in Ecology & Evolution, 20(1): 13–14. https://doi.org/10.1016/j.tree.2004.08.005 |
| ○ |
Rohlf, F. J., 2010. Digitalized Landmarks and Outlines. Stony Brook, Department of Ecology and Evolution, State University of New York. New York. |
| ○ |
Samuel, O. M., Parés-Casanova, P. M., Nwaogu, I. C. & Olopade, J. O., 2015. Geometric morphometrics of the skull of two African rodents, Thryonomys swinderianus and Cricetomys gambianus. Annals of Experimental Biology, 3(2): 21–30. |
| ○ |
Savriama, Y., Neustupa, J. & Klingenberg, C. P., 2010. Geometric morphometrics of symmetry and allometry in Micrasterias rotata (Zygnemophyceae, Viridiplantae). Nova Hedwigia Beiheft, 136: 43–54. |
| ○ |
Spataru, C., Spataru, M., Vulpe, V. & Lazar, M., 2013. The peculiarities of the masticator muscles in rodents. Arquivo Brasileiro de Medicina Veterinaria e Zootecnia, 65(3): 749–756. https://doi.org/10.1590/S0102-09352013000300021 |
| ○ |
Swiderski, D. L., 2003. Separating size from allometry: analysis of lower jaw morphology in the fox squirrel, Sciurus niger. Journal of Mammalogy, 84(3): 861–876. https://doi.org/10.1644/BRB-025 |
| ○ |
Toro Ibacache, M. V., Manriquez Soto, G. & Suazo Galdames, I., 2010. Morfometría geométrica y el estudio de las formas biológicas: de la morfología descriptiva a la morfología cuantitativa geométrica. International Journal of Morphology, 28(4): 977–990. https://doi.org/10.4067/S0717-95022010000400001 |
| ○ |
Watson, P. J., Groning, F., Curtis, N., Fitton, L. C., Herrel, A., McCormack, S. W. & Fagan, M. J., 2014. Masticatory biomechanics in the rabbit: a multi-body dynamics analysis. Journal of The Royal Society Interface, 11(99): 1–14. https://doi.org/10.1098/rsif.2014.0564 |
| ○ |
Webster, M. & Sheets, H. D. 2010. A practical introduction to landmark-based geometric morphometrics. The Palaeontological Society Papers, 16: 163–188. |
| ○ |
Zelditch, M. L., Swiderski, D. L. & Sheets, H. D. 2004. Geometric morphometrics for biologists: a primer. Elsevier Academic Press. Boston. https://doi.org/10.1016/B978-0-12-778460-1.X5000-5 |
Fig. 1.— Hitos (12) utilizados para el estudio de los cráneos de Sylvilagus Gray, 1867 (plano dorsal). Véase el texto para una descripción detallada de cada uno de ellos. Los dos últimos, aquí no representados, fueron colocados sobre un patrón lineal a fin de establecer la longitud cefálica en mm.