DIVERSIDAD DE MOSQUITOS (DIPTERA: CULICIDAE) DE JARABACOA, REPÚBLICA DOMINICANA
María Altagracia Rodríguez Sosa1, Juan Rueda2, Yohan Enmanuel Vásquez Bautista3, Rigoberto Fimia-Duarte4, Miguel Borge de Prada5, Kelvin A. Guerrero6 & Pedro María Alarcón-Elbal7,*
1,3,5,6,7Laboratorio de Entomología, Universidad Agroforestal Fernando Arturo de Meriño (UAFAM), Jarabacoa, República Dominicana.
1https://orcid.org/0000-0003-3497-6557 – a.investigacion1@uafam.edu.do
3https://orcid.org/0000-0002-8989-5757 – a.investigacion2@uafam.edu.do
5https://orcid.org/0000-0002-7815-315X – miguelborge90@gmail.com
6https://orcid.org/0000-0003-1177-3511 – kaguerrero@hotmail.com
7,*Autor para correspondencia: https://orcid.org/0000-0001-5319-4257 – pedro.alarcon@uv.es
2Instituto Cavanilles de Biodiversidad y Biología Evolutiva (ICBiBE), Universidad de Valencia, Paterna, España. https://orcid.org/0000-0002-7629-8881 – juan.rueda@uv.es
4Facultad de Tecnología de la Salud Julio Trigo López, Universidad de Ciencias Médicas de Villa Clara, Cuba. https://orcid.org/0000-0001-5237-0810 – rigobertofd@infomed.sld.cu
| |
RESUMEN
En República Dominicana tienen especial interés, dada su gran relevancia médica, las enfermedades transmitidas por mosquitos. La presente investigación profundiza sobre la diversidad de los culícidos existentes en el municipio de Jarabacoa, a fin de actualizar la información sobre estos dípteros y sus principales sitios de cría, naturales y artificiales. Para tal cometido, se procedió a la búsqueda activa de formas preimaginales mediante la técnica del dipper; se utilizaron pipetas plásticas para muestrear en reservorios de pequeño tamaño. La identificación se llevó a cabo mediante la utilización de lupa binocular y microscopio, con la ayuda de claves taxonómicas específicas. Se capturaron 16 especies pertenecientes a los géneros Aedes Meigen, 1818, Anopheles Meigen, 1818, Culex Linnaeus, 1758, Toxorhynchites Theobald, 1901, Uranotaenia Lynch Arribálzaga, 1891 y Wyeomyia Theobald, 1901, sobre las que se analizaron diversas cuestiones acerca de su bioecología y su papel en la transmisión de agentes patógenos de importancia médica. Se reporta Culex biscaynensis Zavortink & O’Meara, 1999 por primera vez en el Caribe insular, con lo que el número de especies de mosquitos citadas en el país se eleva a 50.
Palabras clave: especies de mosquitos; diversidad; arbovirus; malaria; Jarabacoa; República Dominicana.
|
| |
ABSTRACT
Diversity of mosquitoes (Diptera: Culicidae) from Jarabacoa, Dominican Republic
In the Dominican Republic, mosquito-borne diseases are very interesting due to their great medical relevance. The present research deepens on the diversity of the culicids existing in the municipality of Jarabacoa, in order to update the information on these dipterans and their main breeding sites, natural and artificial. For this purpose, immature stages of mosquitoes were collected by dipping method; plastic pipettes were used for small breeding sites. Sample were identified under a magnifying glass, or under a binocular microscope, with the help of specific taxonomic keys. Sixteen species belonging to the genus Aedes Meigen, 1818, Anopheles Meigen, 1818, Culex Linnaeus, 1758, Toxorhynchites Theobald, 1901, Uranotaenia Lynch Arribálzaga, 1891 and Wyeomyia Theobald, 1901 were collected, on which diverse questions about their bioecology and role on pathogen transmission of medical importance were analyzed. Culex biscaynensis Zavortink & O’Meara, 1999 is recorded for the first time for the Caribbean islands and the number of mosquito species in the country rises to 50.
Keywords: mosquito species; diversity; arbovirus; malaria; Jarabacoa; Dominican Republic.
|
IntroducciónTOP
En República Dominicana tienen especial interés, dada su relevancia médica, las enfermedades transmitidas por mosquitos (Diptera: Culicidae) (Alarcón-Elbal et al., 2017). La malaria y el dengue acaparan el principal foco de atención por ser endémicas en el país, pero también deben tenerse en cuenta otras de reciente aparición como el chikungunya y el Zika, o la filariasis linfática, parasitosis aun no erradicada en La Española (OPS, 2015). Estas enfermedades son responsables de una gran morbimortalidad humana a nivel mundial y muchas están consideradas como enfermedades tropicales desatendidas (ETD) (OMS, 2018), por lo que causan un fuerte perjuicio a las comunidades más desfavorecidas, además de representar un obstáculo considerable al desarrollo de muchas regiones y países en todo el mundo.
Los primeros datos sobre la culicidofauna dominicana se remontan a unas capturas realizadas puntualmente por el entomólogo August Busck en 1905, plasmadas primero en Dyar & Knab (1906) y compiladas más tarde por Howard et al. (1915, 1917). Casi medio siglo después, Belkin & Heinemann (1972) reúnen esta información en un listado sobre los mosquitos de la isla La Española, en la que además hacen ciertas aportaciones y correcciones sobre los trabajos de Dyar & Knab (1906) y Porter (1967), clarificando así algunos aspectos sobre citas dudosas y sinonimias entre especies. Poco después, estos mismos autores realizan aportes novedosos con capturas en 13 provincias del territorio dominicano, con especial énfasis en el Distrito Nacional, San Cristóbal y La Vega (Belkin & Heinemann, 1973). A mediados de la década de los ochenta, Peña & Zaglul (1986) corrigen a Belkin & Heinemann (1972) con respecto a Aedes scapularis (Rondani, 1848), restableciendo la credibilidad al reporte de esta especie realizado por Howard et al. (1917).
Los trabajos realizados en territorio dominicano a finales del siglo XX se centraron, fundamentalmente, en las especies de mayor interés sanitario: entre otros, Mekuria et al. (1990) estudiaron las características bionómicas de los Anopheles Meigen, 1818 en Dajabón; Tidwell et al. (1990) profundizaron en el comportamiento de Aedes aegypti (Linnaeus, 1762) en Santo Domingo; Mekuria et al. (1991) realizaron estudios sobre la susceptibilidad de este aedino a ciertos insecticidas; y Peña (1993) encontró a Aedes albopictus (Skuse, 1894) en el sudoeste de Santo Domingo, en el Parque Mirador del Norte, siendo éste el primer reporte del vector en el Caribe. Ya en el siglo XXI, Peña & Chadee (2004) encontraron a Mansonia dyari Belkin, Heinemann & Page, 1970, Mansonia flaveola (Coquillett, 1906) y Aedeomyia squamipennis (Lynch Arribálzaga, 1878). Recientemente, Rodríguez-Sosa et al. (2018) han hallado por primera vez a Uranotaenia cooki Root, 1937 y Rueda et al. (2018) a Culex garciai González Broche, 2000, siendo ésta la primera cita para La Española. Por tanto, hasta la fecha se han reportado en torno a 49 especies de culícidos en República Dominicana, asumiendo que es difícil de determinar un número exacto a tenor de las controversias existentes en la literatura.
Teniendo en cuenta la gran importancia sanitaria de los mosquitos y la escasez de investigaciones científicas en relación a éstos publicadas en el país (Alarcón-Elbal et al., 2017), el presente estudio tuvo como objetivo determinar la diversidad de los culícidos en una zona de montaña de El Cibao, concretamente en Jarabacoa, y establecer un inventario de las especies potenciales transmisoras de patógenos en la zona.
Material y métodosTOP
Área de estudioTOP
Jarabacoa es un municipio perteneciente a la provincia de La Vega, ubicado en un valle intramontano de la Cordillera Central, a una altura promedio de 530 msnm y con un área de 23 km2. Esta localidad cibaeña, conocida por su benévolo clima primaveral, se ha consolidado en los últimos años como un referente ecoturístico en el Caribe gracias a la riqueza natural que alberga (Orgaz Agüera, 2014), incluyendo numerosas cuencas hídrográficas de gran importancia ecológica asociadas al pico más alto del país y del Caribe, conocido como Pico Duarte (Orgaz Agüera & Cañero-Morales, 2015). Esta localidad presenta un clima tropical lluvioso, con una temperatura promedio anual de 22°C y precipitaciones abundantes durante casi todo el año, habiéndose reportado la mayor pluviosidad especialmente durante los meses de marzo, abril y septiembre en el 2017 (ONAMET, 2018).
Captura de especímenesTOP
Se procedió a la búsqueda activa de lugares de cría y a la catalogación de los mismos en diferentes zonas seleccionadas desde enero a diciembre de 2017. El material biológico se capturó con la ayuda de un dipper, que es un recipiente de plástico de 500 ml acoplado a un tubo telescópico de metal con el que se obtienen alícuotas del medio (Service, 1993). Se utilizaron pipetas plásticas para sortear el material y para los muestreos en reservorios de tamaño reducido, como bromeliáceas. Para su traslado al laboratorio se utilizaron botes plásticos de cierre hermético, debidamente etiquetados. La periodicidad de los muestreos fue semanal, siempre que las condiciones meteorológicas lo permitieron.
Una vez en el laboratorio, las muestras se introdujeron en botes de cría para la maduración de los ejemplares hasta la larva de cuarto estadio (L4), que es la más indicada para fines taxonómicos por el completo desarrollo de la quetotaxia. Después se procedió a su fijación en etanol al 70%, previa muerte por baño de agua caliente a 60°C. Se realizaron preparciones permanentes con parte de este material, utilizando líquido de Hoyer como medio de montaje. Además, se desarrollaron ejemplares hasta el estado de adulto para ratificar la clasificación específica en esta fase de vida, los cuales se sacrificaron con frío y se conservaron en fresco. Se realizaron montajes en alfileres con parte de este material, cuando los individuos fueron hembras, y se realizaron preparciones permanentes de las genitalias de los machos, utilizando líquido de Hoyer.
En todos los casos, tanto en estadios inmaduros como adultos, la identificación se llevó a cabo mediante la utilización de lupa binocular y/o microscopio. Se utilizaron las claves taxonómicas específicas de Belkin et al. (1970), Clark-Gil & Darsie (1983), Darsie & Ward (2005) y González Broche (2006). Es importante señalar la ausencia de claves propias de La Española, como ya advirtieran Marquetti-Fernández et al. (2013) en su estudio realizado en Haití.
Se ha seguido la clasificación taxonómica proporcionada por el Systematic Catalog of Culicidae de la Walter Reed Biosystematics Unit (Gaffigan et al., 2015). El material biológico se encuentra depositado en la Colección del Laboratorio de Entomología de la Universidad Agroforestal Fernando Arturo de Meriño (UAFAM) de Jarabacoa, República Dominicana.
Resultados y discusiónTOP
Se capturaron un total de 2.423 ejemplares de las tres subfamilias de culícidos conocidas (Anophelinae, Culicinae y Toxorhynchitinae), que a su vez se agruparon en seis géneros, 11 subgéneros y 16 especies, lo cual supone aproximadamente un tercio del total de las especies citadas en el país (Tabla 1). De todas ellas, Culex biscaynensis Zavortink & O’Meara, 1999 supone el primer registro para el Caribe insular.
Tabla 1.—Listado de especies de culícidos presentes en Jarabacoa, República Dominicana, agrupado por géneros y por orden alfabético, con información sobre el autor de la primera cita para el país, el número de individuos capturados y los hábitats larvales observados en el presente estudio.
Table 1.—List of culicid species present in Jarabacoa, Dominican Republic, grouped by subgenera and in alphabetical order, with information about the author of the first record for the country, the number of individuals captured and the mosquito larval habitats observed in the present study.
| Especie |
Autor de la primera cita en el país |
Nº de individuos capturados |
Hábitat |
| Anopheles albimanus |
Dyar & Knab (1906) |
38 |
Cuencas hidrográficas y reservorios artificiales |
| An. grabhamii |
Dyar & Knab (1906) |
40 |
Cuencas hidrográficas |
| Culex atratus |
Howard et al. (1915) |
53 |
Cuencas hidrográficas, ambiente fitotélmico y reservorios artificiales |
| Cx. biscaynensis |
Presente estudio |
27 |
Ambiente fitotélmico |
| Cx. corniger |
Howard et al. (1915) |
58 |
Rodadas y reservorios artificiales |
| Cx. garciai |
Rueda et al. (2018) |
18 |
Ambiente fitotélmico y reservorios artificiales |
| Cx. janitor |
Belkin & Heinemann (1972) |
5 |
Reservorios artificiales |
| Cx. nigripalpus |
Howard et al. (1915) |
63 |
Cuencas hidrográficas, rodadas y reservorios artificiales |
| Cx. quinquefasciatus |
Howard et al. (1915) |
381 |
Ambiente fitotélmico y reservorios artificiales |
| Cx. secutor |
Dyar & Knab (1906) |
63 |
Cuencas hidrográficas, ambiente fitotélmico y reservorios artificiales |
| Aedes aegypti |
Howard et al. (1917) |
458 |
Ambiente fitotélmico y reservorios artificiales |
| Ae. albopictus |
Peña (1993) |
555 |
Ambiente fitotélmico y reservorios artificiales |
| Ae. albonotatus |
Dyar & Knab (1906) |
552 |
Ambiente fitotélmico y reservorios artificiales |
| Toxorhynchites portoricensis |
Howard et al. (1917) |
3 |
Reservorios artificiales |
| Wyeomyia mitchellii |
Howard et al. (1915) |
97 |
Ambiente fitotélmico |
| Uranotaenia cooki |
Rodríguez Sosa et al. (2018) |
12 |
Cuencas hidrográficas |
| |
|
2.423 |
|
A continuación se enlistan los taxa encontrados, incluyendo apuntes sobre su distribución, datos de captura, características bioecológicas más relevantes, importancia médica y morfología diferencial.
Tribu AnopheliniTOP
Anopheles (Nyssorrhynchus) albimanus Wiedemann, 1820TOP
DISTRIBUCIÓN: Antillas Mayores y parte de las Antillas Menores, así como ciertas regiones del Norte, Centro y Sudamérica (WRBU, 2018).
CAPTURAS: proximidades del río Yaque del Norte, Pinar Quemado (19°6’20.34”N 70°39’18.97”O, 548 msnm), 03-II-2017, cinco larvas; Arroyo del Berraco, Estancita (19°9’55.81”N 70°40’29.23”O, 515 msnm), 11-VI-2017, ocho larvas; Arroyo del Berraco, Estancita (19°9’55.73”N
70°40’29.25”O, 515 msnm), 13-VI-2017, nueve larvas y dos pupas; Arroyo del Berraco, Estancita (19°7’33.14”N 70°38’50.61”O, 515 msnm), 15-VII-2017, seis larvas; proximidades del río Yaque del Norte, La Poza (19°7’25.35”N 70°38’26.51”O, 536 msnm), 23-VIII-2017, tres larvas; proximidades del río Jimenoa, Hato Viejo (19°7’58.78”N 70°37’55.84”O, 503 msnm, 31-VIII-2017, cuatro larvas; proximidades del río Yaque del Norte, Las Guázaras (19°4’49.82”N 70°42’19.43”O, 657 msnm), 20-IX-2017, una larva.
HÁBITAT: criaderos permanentes y temporales de agua dulce o salobre, con abundante vegetación, donde predominan las algas (García Ávila, 1977); en lagos, riachuelos, pozos, cunetas, huellas de ganado, rodadas, huecos de rocas y cangrejeras, manglares y marismas, con buena iluminación por el sol aunque también en aguas parcial o totalmente sombrías, incluso colonizando depósitos artificiales
(Pérez Vigueras, 1956); tanto en el perímetro urbano como en zonas rurales (Marquetti et al., 1984). En Jarabacoa fue capturada en márgenes de ríos con abundante vegetación y zonas remansadas y sombrías en pequeños arroyos en zonas rurales, asociada a Anopheles grabhamii Theobald, 1901, Culex atratus Theobald, 1901, Culex secutor Theobald, 1901 y Ur. cooki, y también en neumáticos desechados a la interperie (Borge de Prada et al., 2018), junto a Aedes albonotatus (Coquillett, 1905), Ae. albopictus y Cx. secutor.
IMPORTANCIA MÉDICA: vector de gran relevancia en la transmisión de la malaria en América Central y Sudamérica, así como en México e islas del Caribe (Sinka et al., 2010).
Anopheles (Anopheles) grabhamii Theobald, 1901TOP
DISTRIBUCIÓN: Antillas Mayores y parte de las Antillas Menores, y EE.UU. (WRBU, 2018).
CAPTURAS: Puente Amarillo, Pinar Quemado (19°5’50.99”N 70°39’46.53”O, 558 msnm), 17-II-2017, 11 larvas y tres pupas; proximidades del río Baiguate, La Trinchera (19°6’49.86”N 70°37’6.52”O, 537 msnm), 29-III-2017, 10 larvas; Arroyo del Berraco, Estancita
(19°9’55.73”N 70°40’29.25”O, 515 msnm), 13-VI-2017, dos larvas; Arroyo del Berraco, Estancita (19°7’33.14”N 70°38’50.61”O, 515 msnm), 25-VI-2017, cuatro larvas y una pupa; proximidades del río Yaque del Norte - Las Guázaras (19°4’49.82”N 70°42’19.43”O, 657 msnm), 20-IX-2017, nueve larvas.
HÁBITAT: criaderos naturales permanentes y temporales de poca profundidad y sombreados, como cañadas, llegando a habitar incluso en cuevas (García Ávila, 1977). Komp (1942) refiere que esta especie se puede criar, prácticamente, en cualquier depósito de agua, incluso en agua salobre. En Jarabacoa, sus larvas fueron capturadas en zonas rurales y semiurbanas, en arroyos remansados, en lagos y en pozas rocosas con An. albimanus, Cx. secutor, Cx. atratus y Ur. cooki.
IMPORTANCIA MÉDICA: según Belkin et al. (1970) las hembras se alimentan de la sangre de animales domésticos, aunque también pueden hacerlo de sangre humana. Hasta la fecha, no parecen estar incriminados en la transmisión de patógenos a las personas.
IDENTIFICACIÓN: Para las larvas, los caracteres sistemáticos más destacados de cada especie identificada han quedado reflejados en las Figuras 1 a 4. Así, para diferenciar las dos especies del género Anopheles, podemos observar que An. albimanus posee las sedas 1-P y 2-P ancladas en un tubérculo común (Fig. 1A), mientras que no ocurre en An. grabhamii, el cual, además, posee la seda 1-P con cinco a ocho ramas laterales (Fig. 1B) (Belkin et al., 1970).
|
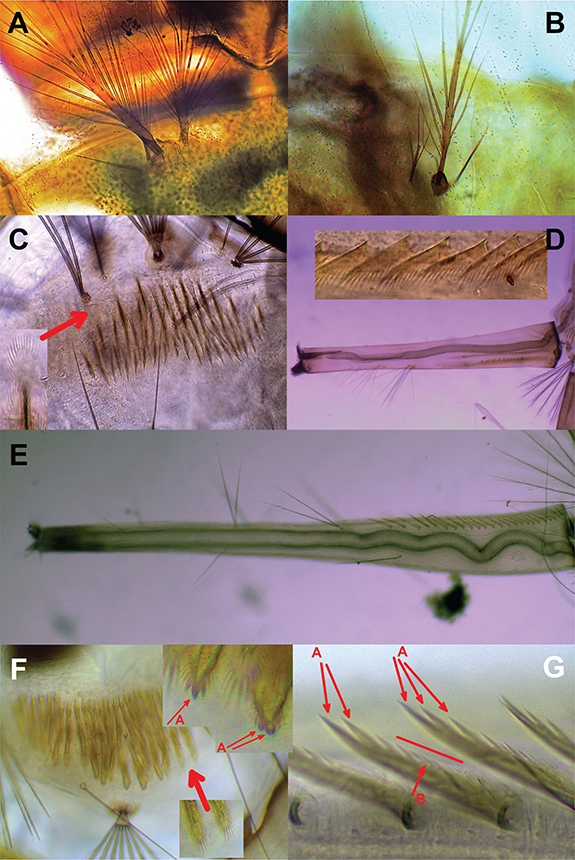 Fig. 1.— A. Anopheles albimanus, tórax, sedas 1-P y 2-P ancladas en un mismo tubérculo. B. Anopheles grabhamii, tórax, sedas 1-P y 2-P separadas, 1-P con ocho ramas. C–D. Culex atratus. C. Espículas del pecten de segmento VIII y detalle de una de ellas. D. Sifón, con detalle de varios dientes del pecten. E–G. Culex biscaynensis. E. Sifón. F. Espículas del pecten del segmento VIII y detalle de dos de ellas. G. Detalle de las espinas. Fig. 1.— A. Anopheles albimanus, tórax, sedas 1-P y 2-P ancladas en un mismo tubérculo. B. Anopheles grabhamii, tórax, sedas 1-P y 2-P separadas, 1-P con ocho ramas. C–D. Culex atratus. C. Espículas del pecten de segmento VIII y detalle de una de ellas. D. Sifón, con detalle de varios dientes del pecten. E–G. Culex biscaynensis. E. Sifón. F. Espículas del pecten del segmento VIII y detalle de dos de ellas. G. Detalle de las espinas.
Fig. 1.— A. Anopheles albimanus, thorax, seta 1, 2-P sharing a common tubercle. B. Anopheles grabhamii, thorax, seta 1, 2-P separated, seta 1-P with 8 branches. C–D. Culex atratus. C. Segment VIII, detail comb scales. D. Siphon, detail of pecten spines. E–G. Culex biscaynensis. E. Siphon. F. Segment VIII, detail of comb scales, G: detail of pecten spines.
|
|
Tribu CuliciniTOP
Culex (Melanoconion) atratus Theobald, 1901TOP
DISTRIBUCIÓN: Antillas Mayores y parte de las Antillas Menores, Brasil, Colombia, EE.UU., Guyana, Panamá y Venezuela (WRBU, 2018).
CAPTURAS: proximidades del río Baiguate, La Trinchera (19°6’48.78”N 70°37’10.98”O, 536 msnm), 29-III-2017, dos larvas y una pupa;
proximidades del río Baiguate, La Trinchera (19°6’49.06”N 70°37’10.50”O, 535 msnm), 31-III-2017, seis larvas; Arroyo del Berraco, Estancita (19°9’55.81”N 70°40’29.23”O, 515 msnm), 11-VI-2017, seis larvas y una pupa; Los Pomos, Estancita (19°7’33.14”N 70°38’50.61”O, 515 msnm), 13-VI-2017, cinco larvas; Arroyo del Berraco, Estancita (19°9’54.81”N 70°40’29.55”O, 518 msnm), 13-VI-2017, 10
larvas; Arroyo del Berraco, Estancita (19°7’33.14”N 70°38’50.61”O, 515 msnm), 25-VI-2017, 10 larvas; proximidades del río Yaque del Norte, Pinar Quemado (19°6’20.32”N 70°39’18.98”O, 548 msnm), 03-VII-2017, 10 larvas y dos pupas.
HÁBITAT: depósitos permanentes como lagunas y presas lacustres, y temporales como charcos de agua de lluvia (González Broche, 2006). Belkin & Heinemann (1973) la encuentran en el país en zonas pantanosas, riberas remansadas de ríos y charcos. En Jarabacoa se capturó siempre en zonas rurales, en pequeños arroyos asociada a An. albimanus, An. grabhamii y Ur. cooki, también en ambiente fitotélmico junto a Ae. albonotatus y Wyeomyia mitchellii (Theobald, 1905), y en residuos sólidos urbanos (RSU), como neumáticos desechados y latas, asociada a Ae. aegypti y Ae. albopictus.
IMPORTANCIA MÉDICA: desconocida
IDENTIFICACIÓN: El género Culex está representado por siete especies. La primera de ellas es Cx. atratus (Figs. 1C-D), destacando especialmente la morfología de las espículas o dientes del pecten del sifón.
Culex (Micraedes) biscaynensis Zavortink & O’Meara, 1999TOP
DISTRIBUCIÓN: este culicino solo ha sido citado en Florida, EE.UU. (Zavortink & O’Meara, 1999), por tanto esta es la primera cita para el Caribe insular y, en consecuencia, para La Española.
CAPTURAS: proximidades del Salto Baiguate (19°5’37.34”N 70°37’2.71”O, 625 msnm), 13-X-2017, 27 larvas.
HÁBITAT: Zavortink & O’Meara (1999) describieron por primera vez esta especie a partir de ejemplares capturados de bromelias exóticas en Florida, EE.UU. Estos investigadores argumentaron que, debido a que no se había encontrado en estudios previos en la zona, cabía la posibilidad de que hubiese sido introducida a través de la importación de estas plantas exóticas. Hasta le fecha solo se ha encontrado en el condado de Miami-Dade, así como en otros condados del sur de Florida (Zavortink & O’Meara, 1999; O´Meara et al., 2003). En Jarabacoa este culícido se ha hallado en axilas de plantas en una zona eminentemente montañosa, en ausencia de otras especies. Es probable que las bromelias exóticas de Florida procedieran del Caribe por lo que, dado el caso, debería considerarse a Cx. biscaynensis como especie exótica en EE.UU.
IMPORTANCIA MÉDICA: desconocida, sin embargo hemos constatado que muestra una antropofilia bien marcada.
IDENTIFICACIÓN: Culex biscaynensis (Figs. 1E-G) pertenece al grupo de especies Cx. bisulcatus. Los carácteres morfológicos han permitido describir varios endemismos caribeños como consecuencia, seguramente, de la importante variabilidad existente dentro de dicho grupo (Zavortink & O’Meara, 1999; O´Meara et al., 2003). Culex biscaynensis presenta un índice de sifón entre 9,2 y 12,2 y el pecten posee entre 15 y 23 espículas débilmente pigmentadas, cada una más larga que la anterior (Fig. 1E), con pequeños dentículos en su parte basal (Fig. 1G:B) y uno a dos más grandes en la distal (Fig. 1G:A). En Cx. biscaynensis, estas características son más similares a Culex antillummagnorum Dyar, 1928 que en Culex bisulcatus (Coquillett, 1905). Sin embargo, una diferencia sutil es que en Cx. biscaynensis las espículas del pecten del segmento VIII tienen elementos distales de la franja agrandados (Fig. 1F:A). El sifón de Cx. biscaynensis generalmente tiene tres pares de sedas subventrales 1-S (Fig. 1E).
Culex (Phenacomyia) corniger Theobald, 1903TOP
DISTRIBUCIÓN: Antillas Mayores y parte de las Antillas Menores, así como ciertas regiones del Norte, Centro y Sudamérica (WRBU, 2018).
CAPTURAS: Arroyo del Berraco, Estancita (19°9’55.86”N 70°40’25.04”O, 509 msnm), 15-VII-2017, 27 larvas y cuatro pupas; proximidades del río Yaque del Norte, Las Guázaras (19°4’49.82”N 70°42’19.43”O, 657 msnm), 14-IX-2017, una larva; proximidades del río Baiguate, La Trinchera (19°6’55.67”N 70°37’15.37”O, 538 msnm), 09-XI-2017, 24 larvas y dos pupas.
HÁBITAT: depósitos naturales temporales con agua de lluvia, preferiblemente en yaguas de palma real y en entrenudos de bambú; ocasionalmente, en latas, tanques de agua, huecos de árboles, orillas de lagunas y cangrejeras (Pérez Vigueras, 1956; Belkin et al., 1970). Se encuentra con frecuencia en el entorno urbano asociada a diferentes RSU (Calderón-Arguedas et al., 2009), preferentemente expuestos a la luz solar (Barrera et al., 1979). Belkin & Heinemann (1973) lo encuentran en el país en neumáticos desechados, tocones de bambú, cáscaras de coco, riberas de ríos y también en yaguas de palma. También ha sido encontrado en colecciones hídricas ricas en materia orgánica, como arroyos contaminados conectados a aguas residuales (Forattini, 2002). Peña & Zaglul (1986) lo encuentran criando en una pileta de cemento en Santo Domingo. En Jarabacoa se encontró en zonas rurales, en charcos en rodadas junto a Culex nigripalpus Theobald, 1901, y en RSU junto a Ae. albonotatus.
IDENTIFICACIÓN: desconocidaTOP
IDENTIFICACIÓN: Culex corniger (Figs. 2A-B), se caracteriza por poseer un sifón corto con unas sedas llamativas sobre su parte media (Fig. 2A) y los dientes del pecten con espinas laterales progresivamente robustas hacía el extremo apical.
|
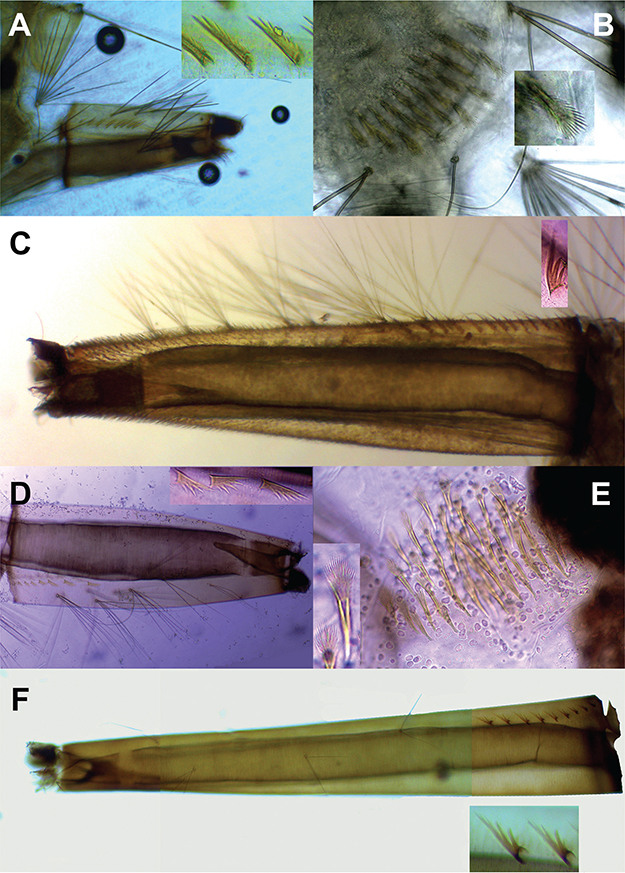 Fig. 2.— A–B. Culex corniger. A. Sifón y detalle de dos espículas. B. Espículas del pecten del segmento VIII y detalle de una de ellas. C. Culex garciai, sifón con detalle de un diente del pecten. D–E. Culex janitor. D. Sifón, con detalle de tres espículas. E. Espículas del pecten del segmento VIII, con detalle de una de ellas. F. Culex nigripalpus, sifón con detalle de un par de espículas. Fig. 2.— A–B. Culex corniger. A. Sifón y detalle de dos espículas. B. Espículas del pecten del segmento VIII y detalle de una de ellas. C. Culex garciai, sifón con detalle de un diente del pecten. D–E. Culex janitor. D. Sifón, con detalle de tres espículas. E. Espículas del pecten del segmento VIII, con detalle de una de ellas. F. Culex nigripalpus, sifón con detalle de un par de espículas.
Fig. 2.— A–B. Culex corniger. A. Siphon, detail of pecten spines. B. Segment VIII, detail of comb scales. C. Culex garciai, siphon, detail of pecten spines. D–E. Culex janitor. D. Siphon, detail of pecten spines. E. Segment VIII, detail of comb scales. F. Culex nigripalpus, siphon, detail of pecten spines.
|
|
Culex (Culex) garciai González Broche, 2000TOP
DISTRIBUCIÓN: Cuba y República Dominicana (González Broche, 2000; Rueda et al., 2018).
CAPTURAS: proximidades del río Yaque del Norte, Pinar Quemado (19°6’21.35”N 70°39’22.62”O, 546 msnm), 10-II-2017, cuatro larvas; proximidades del río Baiguate, La Trinchera (19°6’54.69”N 70°37’7.38”O, 532 msnm), 29-III-2017, una larva; proximidades del río Baiguate, La Trinchera (19°6’50.00”N 70°37’6.69”O, 536 msnm), 29-III-2017, cinco larvas; proximidades del río Yaque del Norte, Las Guázaras (19°4’49.82”N 70°42’19.43”O, 657 msnm), 14-IX-2017, una larva; La Confluencia (19°8’32.08”N 70°38’30.62”O, 528 msnm), 05-VIII-2017, siete larvas.
HÁBITAT: este mosquito se desarrolla en charcos de agua de lluvia y en huecos de rocas en el grupo montañoso oriental de la Sierra Maestra de Cuba, a altitudes alrededor de los 620 msnm (González Broche, 2000). En Jarabacoa sus larvas se han encontrado en entornos agrestes en huecos excavados en las rocas, en tocones de bambú asociada a Culex quinquefasciatus Say, 1823, Cx. secutor y Ae. albonotatus, en charcos de lluvia con Cx. corniger, Cx. nigripalpus y Cx. secutor, y en RSU de material plástico con Ae. albonotatus y Ae. albopictus, a una altitud entre entre los 532 y 657 msnm (Rueda et al., 2018).
IDENTIFICACIÓN: desconocidaTOP
IDENTIFICACIÓN: Con un índice de sifón entre 4,6 y 5,0, Cx. garciai presenta unas pequeñas espinas cada vez más fuertes hacia el ápice del mismo que oscurecen su parte terminal (Fig. 2C). El pecten posee de 12 a 16 dientes, cada uno de estos tiene una espina principal larga y usualmente dos laterales (ver detalle).
Culex (Culex) janitor Theobald, 1903TOP
DISTRIBUCIÓN: Antillas Mayores, Colombia e Islas Caimán (WRBU, 2018).
CAPTURAS: La Confluencia (19 9’8.64”N 70°38’40.31”O, 477 msnm), 14-VII-2017, cinco larvas.
HÁBITAT: habitualmente en cangrejeras, asociada al agua salobre y salada (García Ávila, 1977). Belkin & Heinemann (1973) también lo encuentran en este tipo de criadero en el país, y además en neumáticos desechados y tocones de bambú, asociado a Deinocerites cancer Theobald, 1901, Ae. aegypti, Cx. corniger, Cx. nigripalpus y Cx. quinquefasciatus. Peña & Zaglul (1986) lo encuentran en neumáticos desechados, piletas de cemento y tocones de bambú en Santo Domingo. En Jarabacoa se capturó en botellas plásticas, junto a Ae. albopictus, en un entorno rural.
IDENTIFICACIÓN: desconocidaTOP
IDENTIFICACIÓN: El sifón, con un índice cercano a 4,0, presenta cinco pares de sedas, de las cuales las tres basales son de cinco ramas largas y las dos apicales de dos a tres (Fig. 2D). El pecten presenta de seis a ocho espinas con dientes abiertos entre sí (ver detalle). Las espículas del pecten del segmento VIII se caracterizan por tener unos flecos alargados en la parte apical (Fig. 2E).
Culex (Culex) nigripalpus Theobald, 1901TOP
DISTRIBUCIÓN: Antillas Mayores y gran parte de las Antillas Menores, así como ciertas regiones del Norte, Centro y Sudamérica (WRBU, 2018).
CAPTURAS: Centro Urbano (19°7’23.91”N 70°38’33.39”O, 534 msnm), 12-V-2017, 16 larvas; Arroyo del Berraco, Estancita (19°9’55.79”N
70°40’29.47”O, 515 msnm), 15-VII-2017, 23 larvas y ocho pupas; proximidades del río Yaque del Norte, Las Guázaras (19°4’49.82”N
70°42’19.43”O, 657 msnm), 14-IX-2017, 16 larvas.
HÁBITAT: este mosquito habita en zonas con densa vegetación tropical y elevada humedad, pero puede proliferar oportunistamente en zonas urbanas y semiurbanas (Forattini et al., 1995; Forattini, 2002). Las fases acuáticas se desarrollan en depósitos naturales permanentes como presas lacustres con vegetación, cunetas, cañadas, terrenos arados, pisadas de animales y charcos de agua lluvia; ocasionalmente, en huecos de rocas y depósitos artificiales
(González Broche, 2006). Belkin & Heinemann (1973) lo encuentran en el país en zonas pantanosas, pisadas de animales, lagunas semipermanentes de áreas boscosas, pozas, cangrejeras, márgenes de ríos, cabina de ducha, piscinas, neumáticos desechados y pastizales, asociado a An. albimanus, An. grabhamii, Cx. atratus, Cx. corniger, Cx. duplicator Dyar & Knab, 1909, Cx. inhibitator Dyar & Knab, 1906, Cx. janitor, Cx. pilosus (Dyar & Knab, 1906), Cx. quinquefasciatus, Ae. hemisurus Dyar & Knab, 1906, Ae. mediovittatus (Coquillett, 1906), Ae. tortilis (Theobald, 1903), Psorophora infinis (Dyar & Knab, 1906), Ps. jamaicensis (Theobald, 1901), De. cancer, Ur. lowii Theobald, 1901 y Ae. aegypti. Peña & Zaglul (1986) lo reportan criando en huecos de coralina, charcos, canales de riego, latas y recipientes plásticos. En Jarabacoa se ha encontrado tanto en zona rural, en el margen de un arroyo asociado a An. albimanus y en rodadas junto a Cx. corniger, como en el casco urbano, en RSU (Borge de Prada et al., 2018), asociado a Ae. aegypti, Ae. albopictus y Cx. quinquefasciatus.
IMPORTANCIA MÉDICA: implicado en la transmisión del virus de la encefalitis equina venezolana (VEEV) (Méndez et al., 2001), el virus de la encefalitis de St. Louis (SLEV) (Nayar et al., 1986; Day et al., 1990) y el virus West Nile (WNV) (Turell et al., 2005).
IDENTIFICACIÓN: El sifón de Cx. nigripalpus presenta un índice próximo a 7,0 (Fig. 2F) y entre 10 y 13 espículas con tres o cuatro espinas juntas y una principal más larga (ver detalle). Las espículas del pecten del segmento VIII (Fig. 3A) son muy similares a otras especies del género.
|
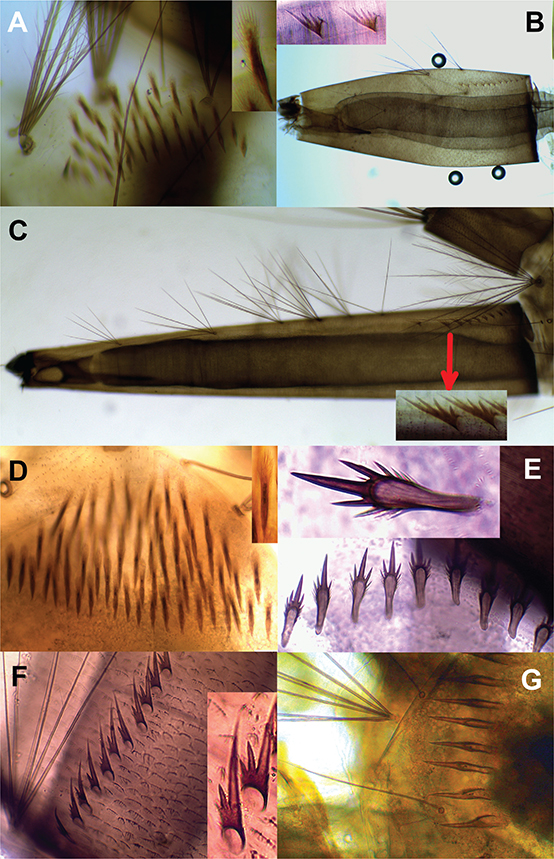 Fig. 3.— A. Culex nigripalpus, espículas del pecten del segmento VIII y detalle de una de ellas. B. Culex quinquefasciatus, sifón con detalle de dos espículas. C–D. Culex secutor. C. Sifón y detalle de dos espículas. D. Espículas del pecten del segmento VIII y detalle de una de ellas. E–F. Aedes aegypti. E. Espículas del pecten del segmento VIII, con detalle de una de ellas. F. Dientes del pecten, con detalle de dos de ellos. G. Aedes albopictus, espículas del pecten del segmento VIII. Fig. 3.— A. Culex nigripalpus, espículas del pecten del segmento VIII y detalle de una de ellas. B. Culex quinquefasciatus, sifón con detalle de dos espículas. C–D. Culex secutor. C. Sifón y detalle de dos espículas. D. Espículas del pecten del segmento VIII y detalle de una de ellas. E–F. Aedes aegypti. E. Espículas del pecten del segmento VIII, con detalle de una de ellas. F. Dientes del pecten, con detalle de dos de ellos. G. Aedes albopictus, espículas del pecten del segmento VIII.
Fig. 3.— A. Culex nigripalpus, segment VIII, detail of comb scales. B. Culex quinquefasciatus, siphon, detail of pecten spines. C–D. Culex secutor. C. Siphon and detail of pecten spines. D. Segment VIII, detail of comb scales. E–F. Aedes aegypti. E. Segment VIII, detail of comb scales. F. Pecten, detail of pecten spines. G. Aedes albopictus, segment VIII.
|
|
Culex (Culex) quinquefasciatus Say, 1823TOP
DISTRIBUCIÓN: cosmopolita, principalmente en América y África tropical, Oriente Medio, sur de Asia, Nueva Guinea, Australia y sur de EE.UU. (WRBU, 2018).
CAPTURAS: Centro Urbano (19°7’29.43”N 70°38’29.35”O, 532 msnm), 04-III-2017, 70 larvas y 16 pupas; proximidades del río Baiguate, La Trinchera (19°6’50.00”N 70°37’6.69”O, 536 msnm), 29-III-2017, tres larvas; proximidades del río Yaque del Norte, La Poza
(19°7’35.67”N 70°38’45.95”O, 529 msnm), 27-IV-2017, 30 larvas y cinco pupas; proximidades del río Yaque del Norte, Yerba Buena
(19°7’15.30”N 70°38’37.72”O, 523 mnsm), 05-V-2017, 21 larvas y cuatro pupas; proximidades del rio Yaque del Norte, Yerba Buena
(19°7’12.59”N 70°38’37.92”O, 523 msnm), 26-V-2017, 18 larvas; La Confluencia (19°7’50.57”N 70°38’33.01”O, 540 msnm), 15-VI-2017, 45 larvas y 19 pupas; proximidades del río Yaque del Norte, La Poza (19°7’25.35”N 70°38’26.51”O, 536 msnm), 28-VIII-2017, 11 larvas; La Confluencia (19°8’32.08”N 70°38’30.62”O, 528 msnm), 27-X-2017, 61 larvas y 74 pupas; El Balcón, Estancita (19°9’12.08”N
70°39’1.29”O, 494 msnm), 27-XI-2017, cuatro larvas.
HÁBITAT: se encuentra, principalmente, en ambiente urbano, pero también se ha constatado su presencia en el medio rural (Foratini, 2002; Quintero & Navarro, 2012). Cría en depósitos naturales y artificiales, tanto permanentes como temporales, normalmente ricos en materia orgánica, con especial afinidad por las fosas, lagunas de oxidación y arroyos contaminados con aguas albañales (González Broche, 2006), mostrando una gran versatilidad en la colonización de diferentes hábitats. Belkin & Heinemann (1973) encuentran larvas de esta especie en bromelias, riberas de ríos, sumideros, charcos, pisadas, neumáticos desechados, huecos de coralina, tocones de bambú y cangrejeras, asociado a An. albimanus, An. grabhamii, Cx. atratus, Cx. corniger, Cx. inhibitator, Cx. janitor, Cx. nigripalpus, Ae. hemisurus, Ae. mediovittatus, Ae. tortilis, Ur. lowii, Ae. aegypti, Ps. jamaicensis y De. cancer. Peña & Zaglul (1986) lo reportan criando en huecos de coralina, charcos, canales de regadío, latas y recipientes plásticos. En Jarabacoa se encontró
tanto en ambientes rurales como urbanos, ocupando un amplio espectro de RSU (Borge de Prada et al., 2018), halladas junto a Ae. aegypti, Ae. albopictus y Cx. nigripalpus; también en axilas de bromelias con Ae. aegypti y Ae. albonotatus.
IMPORTANCIA MÉDICA: está considerado como el vector más eficiente de la filariosis bancroftiana en la región neotropical (Forattini, 2002) y un vector potencial de Dirofilaria immitis (Leidy, 1856) (Lai et al., 2000). En cuanto a la transmisión de arbovirus, es un vector potencial de WNV (Goddard et al., 2002), y también puede transmitir el SLEV, el virus de la encefalitis japonesa (JEV), el virus Ross River (RRV) y el virus Sindbis
(SINV), entre otros (Tsai & Mitchell, 1989).
IDENTIFICACIÓN: El índice de sifón de Cx. quinquefasciatus se sitúa entre 3,8 y 4,0 y el pecten presenta 10 a 12 espículas con una espina principal larga junto con tres a cinco laterales más cortas (Fig. 3B).
Culex (Culex) secutor Theobald, 1901TOP
DISTRIBUCIÓN: Antillas Mayores y parte de las Antillas Menores, y Venezuela (WRBU, 2018).
CAPTURAS: proximidades del río Yaque del Norte, Pinar Quemado (19°7’2.23”N 70°38’18.31”O, 548 msnm), 03-II-2017, 30 larvas; proximidades del río Baiguate, La Trinchera (19°6’49.86”N 70°37’6.52”O, 537 msnm), 29-III-2017, ocho larvas; proximidades del río Yaque del Norte, Estancita Los Pomos (19°7’33.14”N 70°38’50.61”O, 515 msnm), 13-VI-2017, 20 larvas; Arroyo del Berraco, Estancita
(19°9’55.73”N 70°40’29.25”O, 515 msnm), 13-VI-2017, cuatro larvas; proximidades del río Yaque del Norte, Las Guázaras (19°4’49.82”N
70°42’19.43”O, 657 msnm), 20-IX-2017, una larva.
HÁBITAT: depósitos naturales y artificiales como tanques y huecos de árboles (González Broche, 2006). En nuestro caso, las formas preimaginales fueron capturadas en neumáticos desechados junto con Ae. albopictus, Ae. albonotatus y An. albimanus, en tocones de bambú con Ae. albopictus y Ae. albonotatus, en la ribera del río Yaque del Norte y en lagunas permanentes adyacentes al río Baiguate con An. grabhamii, siempre en ambientes rurales y semiurbanos.
IMPORTANCIA MÉDICA: desconocida
IDENTIFICACIÓN: El sifón de Cx. secutor posee un índice alrededor de 6,0 con un pecten de 15 a 17 espículas con una espina principal larga con dos o tres más cortas en un lateral (Fig. 3C). El segmento VIII presenta un pecten con tres a cuatro hileras de largas espículas que presentan flecos cortos en el ápice
(Fig. 3D).
Tribu AediniTOP
Aedes (Stegomyia) aegypti (Linnaeus, 1762)TOP
DISTRIBUCIÓN: cosmotropical, presente en todos los continentes abarcando regiones tropicales y templadas (Kraemer et al., 2015).
CAPTURAS: Urb. María Auxiliadora (19°6’44.76”N 70°38’15.35”O, 556 msnm), 17-I-2017, 130 larvas; La Confluencia (19°7’55.63”N 70°38’32.91”O, 538 msnm), 14-II-2017, tres larvas; Puente Amarillo, Pinar Quemado (19°5’50.99”N 70°39’46.53”O, 558 msnm), 17-II-2017, 13
larvas y tres pupas; Centro Urbano (19°7’29.43”N 70°38’29.35”O, 532 msnm), 04-III-2017, una larva; proximidades del Río Yaque del Norte, La Poza (19°7’32.90”N 70°38’38.26”O, 525 msnm), 15-III-2017, 40 larvas y siete pupas; La Confluencia (19°7’55.63”N
70°38’32.89”O, 538 msnm), 31-III-2017, 68 larvas y 15 pupas; La Colonia Agrícola (19°6’54.58”N 70°38’22.55”O, 547 msnm), 31-III-2017, 35 larvas; proximidades del río Yaque del Norte, El Bolsillo (19°7’22.42”N 70°38’44.73”O, 516 msnm), 07-IV-2017, ocho larvas y dos pupas; Centro Urbano (19°7’26.21”N 70°38’27.18”O, 531 msnm), 20-IV-2017, siete larvas; proximidades del río Yaque del Norte, La Poza (19°7’35.67”N 70°38’45.95”O, 529 msnm), 27-IV-2017, tres larvas; Centro Urbano (19°7’23.91”N 70°38’33.39”O, 534 msnm), 12-V-2017, 36 larvas; El Bolsillo (19°7’23.85”N 70°38’43.79”O, 515 msnm), 21-V-2017, cinco larvas; Yerba Buena
(19°7’12.59”N 70°38’37.92”O, 523 msnm), 26-V-2017, una larva; proximidades del río Baiguate, La Trinchera (19°6’53.91”N 70°37’11.90”O, 534 msnm), 18-VIII-2017, siete larvas y tres pupas; La Confluencia (19°8’32.08”N 70°38’30.62”O, 528 msnm), 27-X-2017, una larva; Los Pomos, Estancita (19°7’44.74”N 70°38’50.70”O, 512 msnm), 01-XI-2017, 15 larvas y seis pupas; El Balcón, Estancita
(19°9’12.08”N 70°39’1.29”O, 494 msnm), 27-XI-2017, tres larvas; Pinar Dorado (19°7’8.19”N 70°37’58.52”O, 548 msnm), 01-XII-2017, una larva; La Confluencia (19°8’11.65”N 70°38’30.23”O, 533 msnm), 04-XII-2017, 39 larvas y seis pupas.
HÁBITAT: todo tipo de depósitos artificiales, alrededor de las viviendas y dentro de ellas, así como en dendrotelmas (González Broche, 2006; Diéguez Fernández et al., 2012, 2015). En Jarabacoa se ha encontrado en zonas eminentemente rurales pero también en el casco urbano, en un amplio rango de RSU de diferente tipología (Borge de Prada et al., 2018), asociada a Ae. albopictus, Ae. albontatus, Cx. atratus, Cx. nigripalpus y Cx. quinquefasciatus; también en ambiente fitotélmico junto a Ae. albopictus, Cx. quinquefasciatus y Wy. mitchellii.
IMPORTANCIA MÉDICA: es el principal vector de arbovirus como la fiebre amarilla (YFV) urbana (Monath, 1989), dengue (DENV) (Delatte et al., 2008), chikungunya (CHIKV) (Pialoux et al., 2007) y Zika (ZIKV) (Marchette et al., 1969), entre otros.
IDENTIFICACIÓN: Aedes aegypti posee una única fila de espículas en el pecten del segmento VIII, cada una de ellas presenta una espina central larga con otra mediana a cada lado acompañadas por otras dos o tres más débiles (Fig. 3E). El pecten del sifón está estructurado con 12 a 16 dientes, que a su vez poseen una espina principal acompañada por dos o tres más pequeñas y basales (Fig. 3F).
Aedes (Stegomyia) albopictus (Skuse, 1894)TOP
DISTRIBUCIÓN: cosmotropical, presente en todos los continentes abarcando regiones tropicales y templadas (Kraemer et al., 2015).
CAPTURAS: El Mirador (19°6’35.40”N 70°38’30.72”O, 541 msnm), 10-I-2017, 15 larvas y 13 pupas; La Confluencia (19°9’8.58”N 70°38’34.38”O, 479 msnm), 27-I-2017, 55 larvas y cuatro pupas; proximidades del río Yaque del Norte, Pinar Quemado (19°6’20.34”N 70°39’18.97”O, 548 msnm), 03-II-2017, ocho larvas; proximidades del río Yaque del Norte, Pinar Quemado (19°6’19.04”N 70°39’19.25”O, 549 msnm), 10-II-2017, seis larvas; proximidades del río Baiguate, La Trinchera (19°6’50.00”N 70°37’6.69”O, 536 msnm), 29-III-2017, 26
larvas; La Colonia Agrícola (19°6’54.58”N 70°38’22.55”O, 547 msnm), 31-III-2017, 83 larvas y 14 pupas; El Bolsillo (19°7’23.85”N
70°38’43.79”O, 515 msnm), 21-V-2017, dos larvas; proximidades del río Yaque del Norte, Pinar Quemado (19°6’20.32”N 70°39’18.98”O, 548 msnm), 03-VII-2017, 40 larvas y 12 pupas; La Confluencia (19°9’8.64”N 70°38’40.31”O, 477 msnm), 14-VII-2017, 12 larvas;
Arroyo del Berraco, Estancita (19°9’55.86”N 70°40’25.04”O, 509 msnm), 15-VII-2017, 16 larvas; proximidades del río Baiguate, La Trinchera (19°6’53.91”N 70°37’11.90”O, 534 msnm), 18-VIII-2017, 180 larvas y 34 pupas; proximidades del río Yaque del Norte, Las Guázaras (19°4’49.82”N 70°42’19.43”O, 657 msnm), 20-IX-2017, 12 larvas; Colina de los Pomos (19°7’40.39”N 70°38’21.38”O, 533 msnm), 27-IX-2017, cinco larvas; La Confluencia (19°8’32.08”N 70°38’30.62”O, 528 msnm), 05-X-2017, nueve larvas; Los Pomos, Estancita (19°7’44.74”N 70°38’50.70”O, 512 msnm), 01-XI-2017, dos pupas; El Balcón, Estancita (19°9’12.08”N 70°39’1.29”O, 494 msnm), 27-XI-2017, tres larvas.
HÁBITAT: se reproducen en depósitos naturales como huecos de árboles, tocones de bambú, axilas de plantas y cáscaras de coco, pero también en una amplia gama de recipientes artificiales en áreas urbanas, en el ambiente peridoméstico, como bidones, neumáticos desechados, macetas y otros recipientes de muy diversa composición (Paupy et al., 2009). En el municipio se ha encontrado ampliamente por zonas rurales y urbanas, en diferentes recipientes artificiales, con especial
énfasis en los RSU (Borge de Prada et al., 2018), junto a Ae. aegypti, Ae. albonotatus, An. albimanus, Cx. atratus, Cx. janitor, Cx. secutor y Toxorhynchites portoricensis (Von Röder, 1885) también en criaderos de origen natural, como bromelias y troncos de bambú, con Ae. albonotatus y Cx. secutor.
IMPORTANCIA MÉDICA: vector competente de arbovirus como el DENV, CHIKV (Delatte et al., 2008) y ZIKV (Weger-Lucarelli et al., 2016), entre otros. En lo que concierne a helmintos, es considerado como transmisor de D. immitis (Apperson et al., 1989).
IDENTIFICACIÓN: Las espículas del pecten del segmento VIII se cuentan entre 8 y 10 (Fig. 3G). Cada una de ellas presenta una única espina principal larga con flecos basales cortos y delgados. El sifón tiene un índice cercano a 3,0 con el pecten con 9 a 13 dientes muy similares a la especie anterior (Fig. 4A).
|
 Fig. 4.— A. Aedes albopictus, dientes del pecten y detalle de dos de ellos. B–C. Aedes albonotatus. B. Sifón. C. Espículas del pecten del segmento VIII y detalle de una de ellas. D. Toxorhynchites portoricensis, segmentos terminales. E–F. Wyeomyia mitchellii. E. Sifón. F. Espículas del pecten del segmento VIII. G. Uranotaenia cooki, sifón con detalle de un diente del pecten. Fig. 4.— A. Aedes albopictus, dientes del pecten y detalle de dos de ellos. B–C. Aedes albonotatus. B. Sifón. C. Espículas del pecten del segmento VIII y detalle de una de ellas. D. Toxorhynchites portoricensis, segmentos terminales. E–F. Wyeomyia mitchellii. E. Sifón. F. Espículas del pecten del segmento VIII. G. Uranotaenia cooki, sifón con detalle de un diente del pecten.
Fig. 4.— A: pecten of Aedes albopictus, pecten and detail of two pecten spines. B–C. Aedes albonotatus. B. Siphon. C. Segment VIII, detail of comb scales. D. Toxorhynchites portoricensis, terminal segments. E–F. Wyeomyia mitchellii. E. Siphon. F. Comb scales. G. Uranotaenia cooki, siphon and detail of a pecten spine.
|
|
Aedes (Howardina) albonotatus (Coquillett, 1905)TOP
DISTRIBUCIÓN: Bahamas, Ecuador, La Española y Venezuela (WRBU, 2018).
CAPTURAS: proximidades del río Yaque del Norte, Pinar Quemado (19°6’20.34”N 70°39’18.97”O, 548 msnm), 03-II-2017, 20 larvas y 36 pupas;
proximidades del río Yaque del Norte, Pinar Quemado (19°6’19.04”N 70°39’19.25”O, 549 msnm), 10-II-2017, 41 larvas; proximidades del río Baiguate, La Trinchera (19°6’54.69”N 70°37’7.38”O, 532 msnm), 29-III-2017, 93 larvas; proximidades del río Baiguate, La Trinchera (19°6’49.06”N 70°37’10.50”O, 535 msnm), 31-III-2017, una larva; La Colonia Agrícola (19°6’54.58”N 70°38’22.55”O, 547 msnm), 31-III-2017, una pupa; vivienda particular, Pinar Quemado (19°6’20.32”N 70°39’18.98”O, 548 msnm), 03-VII-2017, 30 larvas y 12 pupas; proximidades del río Jimenoa, La Confluencia (19°9’8.64”N 70°38’40.31”O, 477 msnm), 14-VII-2017, dos larvas; Arroyo del Berraco, Estancita (19°9’55.86”N 70°40’25.04”O, 509 msnm), 15-VII-2017, 70 larvas y tres pupas; proximidades del río Baiguate (19°6’49.55”N 70°37’9.81”O, 534 msnm), 18-VIII-2017, 149 larvas y 53 pupas; próximidades del río Yaque del Norte, Las Guázaras (19°4’49.82”N 70°42’19.43”O, 657 msnm), 20-IX-2017, 10 larvas y una pupa; Colina de los Pomos (19°7’40.39”N
70°38’21.38”O, 533 msnm), 27-IX-2017, 11 larvas; Los Pomos, Estancita (19°7’44.74”N 70°38’50.70”O, 512 msnm), 01-XI-2017, 12 larvas; El Mirador (19°6’34.50”N 70°38’31.29”O, 541 msnm), 11-XII-2017, siete larvas.
HÁBITAT: frecuentemente ligado al entorno doméstico en reservorios artificiales como neumáticos desechados y latas, aunque también en entornos rurales en ambiente fitotélmico (Spielman & Weyer, 1965). En Jarabacoa se ha encontrado tanto en entornos rurales como urbanos, fundamentalmente en neumáticos desechados junto a
Ae. aegypti, Ae. albopictus, An. albimanus y Tx. portoricensis, pero también en otros RSU y en axilas de plantas, asociado a Cx. atratus y Wy. mitchellii.
IMPORTANCIA MÉDICA: ciertos estudios sugieren que este aedino carece de importancia en la transmisión de arbovirus (Llewellyn et al., 1970). Hemos constatado que muestra una antropofilia bien marcada.
IDENTIFICACIÓN: El sifón de Ae. albonotatus posee un índice cercano a 2,0 y las espículas del pecten son similares a los de Ae. albopictus, acabando la seda 1-S justo en el último de ellos (Fig. 4B). El segmento VIII posee un pecten con entre 10 y 17 espículas con espinas muy finas que se sitúan alrededor de la punta
(Fig. 4C).
Tribu ToxorhynchitiniTOP
Toxorhynchites (Lynchiella) portoricensis (Von Röder, 1885)TOP
DISTRIBUCIÓN: Antillas Mayores y Montserrat (WRBU, 2018).
CAPTURAS: proximidades del río Yaque del Norte, Pinar Quemado (19°6’20.34”N 70°39’18.97”O, 548 msnm), 10-II-2017, dos larvas; vivienda particular, Hato Viejo (19°08’00.2”N 70°37’47.6”O, 563 msnm), 17-11-2017, una pupa.
HÁBITAT: huecos de árboles de zonas boscosas (González Broche, 2006). En Jarabacoa se encontró siempre en entornos rurales, criando en neumáticos desechados junto a Ae. aegypti, Ae. albopictus y Ae. albonotatus.
IMPORTANCIA MÉDICA: este género está conformado por individuos no hematófagos y hembras autógenas, por lo que carece completamente de importancia sanitaria. Sus larvas poseen hábitos depredadores y consumen individuos inmaduros de otros mosquitos, por tanto tiene interés en relación a estudios de control biológico (Barajas et al., 2013).
IDENTIFICACIÓN: El género Toxorhynchites comprende a especies de gran tamaño y normalmente muy pigmentadas. El segmento VIII no posee pecten de espículas, solo una gran placa quitinizada con un par de sedas simples gruesas y tres pequeñas, poco aparentes. De la misma manera, el sifón, con un índice de 2,0 a 2,5, carece de pecten (Fig. 4D).
Tribu SabethiniTOP
Wyeomyia (Wyeomyia) mitchellii (Theobald, 1905)TOP
DISTRIBUCIÓN: Antillas Mayores, así como ciertas regiones de Norte y Centroamérica, y Brasil (WRBU, 2018).
CAPTURAS: Arroyo del Berraco, Estancita (19°9’55.19”N 70°40’14.15”O, 505 msnm), 27-II-2017, 25 larvas y tres pupas; proximidades del río Baiguate, La Trinchera (19°6’49.07”N 70°37’10.47”O, 536 msnm), 29-III-2017, 19 larvas y seis pupas; proximidades del río Baiguate, La Trinchera (19°6’49.06”N 70°37’10.50”O, 535 msnm), 31-III-2017, 16 larvas; proximidades del río Baiguate, La Trinchera
(19°6’49.55”N 70°37’9.81”O, 534 msnm), 18-VIII-2017, 10 larvas; Arroyo del Berraco, Estancita (19°9’55.28”N 70°40’14.07”O, 505 msnm), 20-XI-2017, cuatro larvas; Pinar Dorado (19°7’8.19”N 70°37’58.52”O, 548 msnm), 01-XII-2017, siete larvas y dos pupas; El Mirador (19°6’34.50”N 70°38’31.29”O, 541 msnm), 11-XII-2017, cuatro larvas y una pupa.
HÁBITAT: típica de zonas boscosas, con predilección por las axilas de las bromelias aéreas y terrestres (García Ávila, 1977), también en las hojas y oquedades de las plantas, en los entrenudos de bambú y en huecos de árboles frondosos (Carpenter & LaCasse, 1955). En Jarabacoa sus formas preimaginales se hallaron en entornos rurales y semiurbanos, en axilas de plantas asociada a Ae. aegypti, Ae. albonotatus y Cx. atratus.
IMPORTANCIA MÉDICA: algunos arbovirus, como el VEEV, fueron encontrados en esta especie, pero su potencial transmisor no ha sido todavía bien definido (Scherer et al., 1971). Hemos constatado que muestra una antropofilia bien marcada.
IDENTIFICACIÓN: Las especies del género Wyeomyia se caracterizan porque su sifón carece de pecten. Wyeomyia mitchellii tiene un índice de sifón de 4,0 a 4,7 con las sedas 1-S habitualmente simples (Fig. 4E). Las espículas del pecten del segmento VIII forman una única hilera (Fig. 4F).
Tribu UranotaeniiniTOP
Uranotaenia (Uranotaenia) cooki Root, 1937TOP
DISTRIBUCIÓN: es una especie endémica de las Antillas Mayores y las Islas Vírgenes (WRBU, 2018).
CAPTURAS: Arroyo del Berraco, Estancita (19°9’55.81”N 70°40’29.23”O, 515 msnm), 11-VI-2017, tres larvas; Arroyo del Berraco, Estancita
(19°7’33.14”N 70°38’50.61”O, 515 msnm, 13-VI-2017, siete larvas; Arroyo del Berraco, Estancita (19°9’55.75”N 70°40’29.45”O, 515 msnm), 03-IX-2017, dos larvas.
HÁBITAT: ecosistemas acuáticos lénticos, preferentemente en zonas de umbría, como remansos de ríos, pozas y cañadas donde el agua permanece tranquila, con materia orgánica de origen vegetal en el fondo (Howard et al., 1915; Pérez Vigueras, 1956; Belkin et al., 1970; Belkin & Heinemann, 1975). En Jarabacoa se ha encontrado habitando en pozas de poca profundidad, lecho arenoso, agua tranquila y con gran acumulación de hojas en el fondo, en un entorno totalmente agreste (Rodríguez-Sosa et al., 2018), junto a An. albimanus, An. grabhami, Cx. atratus y Cx. secutor.
IMPORTANCIA MÉDICA: se alimenta de la sangre de vertebrados poiquilotermos, fundamentalmente anfibios y reptiles (Pratt, 1946; Belkin et al., 1970; García Ávila, 1977), por lo que carece de relevancia médica.
Identificación: Uranotaenia cooki tiene entre 10 y 13 espículas largas y delgadas en el segmento VIII implantadas en el borde posterior de la placa que caracteriza el género y un índice del sifón de 4,5 a 5,0 donde las sedas 1-S se sitúan sobre su mitad y entre 15 a 17 dientes en el pecten
(Fig. 4G).
En relación a la abundancia general, 64,6% (n= 1565) de los individuos capturados pertenecieron al género Aedes, siendo la especie Ae. albopictus la más abundante durante el estudio, con 22,9% (n= 555). El género Culex, aun siendo el más prolífico en cuanto a número de especies, contó con una abundancia total de 27,6% (n= 668) (Tabla 1). De las 16 especies identificadas, cinco han sido fehacientemente reportadas en la literatura científica como vectores de patógenos al humano (An. albimanus, Cx. nigripalpus, Cx. quinquefasciatus, Ae. aeypti y Ae. albopictus), lo que significa que el 31,2% de las especies y el 61,7% (n= 1495) de los especímenes tienen interés sanitario.
Los viajes y el comercio internacionales, los cambios en las prácticas agrícolas, la urbanización no planificada, la falta de suministro de agua corriente y los problemas medioambientales (cambio climático, deforestación o contaminación por RSU, entre otros) son factores que incrementan el riesgo de transmisión de enfermedades transmitidas por mosquitos en República Dominicana (OMS, 2017; Alarcón-Elbal, 2018; Borge de Prada et al., 2018). Por tanto, es primordial fomentar invesigación de calidad para tratar de comprender cómo afectará la interrelación de estos factores a la salud de la población dominicana, especialmente a través del estudio de los insectos que transmiten patógenos.
AgradecimientosTOP
Los resultados del presente documento derivan íntegramente del proyecto “Sistema integrado de educación y vigilancia entomológica para la prevención y el control de enfermedades vehiculizadas por mosquitos (Diptera: Culicidae) en dos polos turísticos de República Dominicana”, subvencionado por el Fondo Nacional de Innovación y Desarrollo Científico y Tecnológico (FONDOCyT), Ministerio de Educación Superior, Ciencia y Tecnología (MESCyT). Asimismo, los autores desean agradecer encarecidamente a los administradores del Rancho Baiguate, por su implicación oficial en el proyecto y el apoyo incondicional brindado a los miembros de este equipo de investigación. Se agradece el minucioso trabajo del Dr. Gustavo C. Rossi y de otro revisor anónimo que han contribuido, con sus correcciones, sugerencias y aportaciones, a mejorar sustancialmente la calidad de este manuscrito.
ReferenciasTOP
| ○ |
Alarcón-Elbal, P. M., 2018. Deforestation and mosquito-borne diseases: another ‘wake-up call’ to Latin America. InterAmerican Journal of Medicine and Health, 1(1): e201801003. https://doi.org/10.31005/iajmh.v1i1.23 |
| ○ |
Alarcón-Elbal, P. M., Paulino-Ramírez, R., Diéguez-Fernández, L., Fimia-Duarte, R., Guerrero, K. A. & González, M., 2017. Arbovirosis transmitidas por mosquitos (Diptera: Culicidae) en la República Dominicana: una revisión. The Biologist (Lima), 15(1): 193–219. https://doi.org/10.24039/rtb2017151155 |
| ○ |
Apperson, C. S., Engber, B. & Levine, J. F., 1989. Relative suilability of Aedes albopictus and Aedes aegypti in North Carolina to support development of Dirofilaria immitis. Journal of American Mosquito Control Association, 5: 377–382. |
| ○ |
Barajas, J., Suaza, J. D., Torres, C., León Rúa, G., Uribe-Soto, S. & Porter, C. H., 2013. Mosquitos (Diptera: Culicidae) asociados a guadua en los municipios de Anserma, Hispania y Jardín, Colombia. Revista Colombiana de Entomología, 39(1): 132–140. |
| ○ |
Barrera, R., Machado-Alison, C. E. & Bulla, L. A., 1979. Criaderos, densidad larval y segregación de nicho en tres Culicidae urbanos (Culex fatigans Wied., C. corniger Theo. y Aedes aegypti L.) en el cementerio de Caracas. Acta Científica Venezolana, 30: 418–424. |
| ○ |
Belkin, J. N. & Heineman, S., 1972. A tentative annotated list of the Culicidae of the Island of Hispaniola. Mosquito Systematics, 4: 42–63. |
| ○ |
Belkin, J. N. & Heineman, S., 1973. Collection records of the project “Mosquitoes of Middle America”, Introduction: Dominican Republic. Mosquito Systematics, 5: 201–222. |
| ○ |
Belkin, J. N. & Heineman, S., 1975. Collection records of the project “Mosquitoes of Middle America.” 2. Puerto Rico (PR, PRA, PRX) and Virgin Is. (VI, VIA). Mosquito Systematics, 7: 269–296. |
| ○ |
Belkin, J. N., Heinemann, S. J. & Page, W. A., 1970. The culicidae of Jamaica (Insecta: Diptera). Bulletin of the Institute of Jamaica (Science Series), 20: 450–458. |
| ○ |
Borge de Prada, M., Rodríguez Sosa, M. A., Vásquez Bautista, Y. E., Guerrero, K. A. & Alarcón-Elbal, P. M., 2018. Mosquitos (Diptera, Culicidae) de importancia médica asociados a residuos sólidos urbanos en Jarabacoa, República Dominicana. Revista Salud Jalisco, Número Especial, 20–27. |
| ○ |
Calderón-Arguedas, O., Troyo, A., Solano, M. E., Avendaño, A. & Beier, J. C., 2009. Urban mosquito species (Diptera: Culicidae) of dengue endemic communities in the Greater Puntarenas area, Costa Rica. Revista de Biología Tropical, 57(4): 1223–1234. https://doi.org/10.15517/rbt.v57i4.5459 |
| ○ |
Carpenter, S. L. & LaCasse, J., 1955. Mosquitoes of North America (North of Mexico). University of California Press. Berkeley & Los Angeles. 369 pp. |
| ○ |
Clark-Gil, S. & Darsie, R.F., 1983. The mosquitoes of Guatemala their identification, distribution and bionomics. Mosquito Systematics, 15(3): 151–284. |
| ○ |
Darsie, R. F. & Ward, R. A., 2005. Identification and geographical distribution of the Mosquitoes of North America, North of Mexico. University of Florida Press. Gainesville. 383 pp. |
| ○ |
Day, J. F., Curtis, G. A. & Edman, J. D., 1990. Rainfall-directed oviposition behavior of Culex nigripalpus (Diptera: Culicidae) and its influence on St. Louis encephalitis virus transmission in Indian River County, Florida. Journal of Medical Entomology, 27: 43–50. https://doi.org/10.1093/jmedent/27.1.43 |
| ○ |
Delatte, H., Paupy, C., Dehecq, J. S., Thiria, J., Failloux, A. B. & Fontenille, D., 2008. Aedes albopictus, vector of chikungunya and dengue viruses in Reunion Island: biology and control. Parasite, 15(1): 3–13. |
| ○ |
Diéguez Fernández, L., Andrés García, J., San Martín Martínez, J. L., Fimia Duarte, R., Iannacone, J. & Alarcón-Elbal, P. M., 2015. Comportamiento estacional y relevancia de los depósitos permanentes y útiles para la presencia de Stegomyia (Stegomyia) aegypti en Camagüey, Cuba. Neotropical Helminthology, 9(1): 103–111. |
| ○ |
Diéguez Fernández, L., Mapolón Maceo, L., Sosa Cabrera, I., Pérez Arruti, A. E., Salaverry Valera, F. & Fimia Duarte, R., 2012. Principales especies de culícidos de relevancia medico veterinaria presentes en un Área de Salud de la provincia Camagüey, Cuba. REDVET, 13: 05B. Disponible en: http://www.veterinaria.org/revistas/redvet/n050512B/011ATM01.pdf [consultado 15 Jul. 2018] |
| ○ |
Dyar, H. G. & Knab, F., 1906. The larvae of Culicidae classified as independent organisms. Journal of the New York Entomological Society, 14(4): 169–230. |
| ○ |
Forattini, O. P. 2002. Culicidología Médica. Universidad de São Paulo. São Paulo. 859 pp. |
| ○ |
Forattini, O. P., Kakitani, I., Massad, E. & Marucci, D., 1995. Studies on mosquitoes (Diptera: Culicidae) and anthropic environment. 10- Survey of adult behaviour of Culex nigripalpus and other species of Culex (Culex) in south-eastern Brazil. Revista de Saúde Pública, 29(4): 271–278. |
| ○ |
García Ávila, I. 1977. Fauna cubana de mosquitos y sus criaderos típicos. Academia de Ciencias de Cuba. La Habana. 108 pp. |
| ○ |
Gaffigan, T. V., Wilkerson, R. C., Pecor, J. E., Stoffer, J. A. & Anderson, T., 2015. Systematic Catalog of Culicidae. Walter Reed Biosystematics Unit. Disponible en: http://www.mosquitocatalog.org/intro.aspx [consultado 15 Jul. 2018] |
| ○ |
Goddard, L. B., Roth, A. E., Reisen, W. K. & Scott, T. W., 2002. Vector competence of California mosquitoes for West Nile Virus. Emerging Infectious Diseases, 8(12): 1385–1391. https://doi.org/10.3201/eid0812.020536 |
| ○ |
González Broche, R., 2000. Dos nuevas especies de mosquitos de los géneros Psorophora (Grabhamia) y Culex (Culex) (Diptera, Culicidae), de Cuba. Revista Brasileira de Entomologia, 44(1–2): 27–33. |
| ○ |
González Broche, R., 2006. Culícidos de Cuba. Editorial Científico Técnica. La Habana. 184 pp. |
| ○ |
Howard, L. O., Dyar, H. G. & Knab, F., 1915. The mosquitoes of North and Central America and the West Indies. Vol. III. Carnegie Institution of Washington. Washington D.C. 524 pp. |
| ○ |
Howard, L. O., Dyar, H. G. & Knab, F., 1917. The mosquitoes of North and Central America and the West Indies. Vol. IV. Carnegie Institution of Washington. Washington D.C. pp. 525–1064. |
| ○ |
Komp, W. H. W., 1942. The anopheline mosquitoes of the Caribbean Region. National Institute of Health Bulletin, 179: 1–195. |
| ○ |
Kraemer, M. U., Sinka, M. E., Duda, K. A., Mylne, A. Q., Shearer, F. M., Barker C.M., Moore, C.G., Carvalho, R. G., Coelho, G. E., Bortel, W. van, Hendrickx, G., Schaffner, F., Elyazar, I. R. F., Teng, H.-J., Brady, O. J., Messina, J. P., Pigott, D. M., Scott, T. W., Smith, D. L., William Wint, G. R., Golding, N. & Hay, S. I., 2015. The global distribution of the arbovirus vectors Aedes aegypti and Ae. albopictus. Elife, 4:e08347. https://doi.org/10.7554/eLife.08347 |
| ○ |
Lai, C. H., Tung, K. C., Ooi, H. K. & Wang, J. S., 2000. Competence of Aedes albopictus and Culex quinquefasciatus as vector of Dirofilaria immitis after blood meal with different microfilarial density. Veterinary Parasitology, 90: 231–237. https://doi.org/10.1016/S0304-4017(00)00242-9 |
| ○ |
Llewellyn, C. H., Spielman, A. & Frothingham, T. E., 1970. Survival of arboviruses in Aedes albonotatus, a peridomestic Bahaman mosquito. Experimental Biology and Medicine, 133(2): 551–554. https://doi.org/10.3181/00379727-133-34516 |
| ○ |
Marchette, N. J., García, R. & Rudnick, A., 1969. Isolation of Zika virus from Aedes aegypti mosquitoes in Malaysia. The American Journal of Tropical Medicine and Hygiene, 18: 411–415. https://doi.org/10.4269/ajtmh.1969.18.411 |
| ○ |
Marquetti, M. C., Sosa, E., Bisset, J. & Navarro, A., 1984. Estudio estacional de la densidad larval de Anopheles albimanus (Wiedemann 1821) y algunos factores climáticos y físico-químicos en un criadero urbano. Revista Cubana de Medicina Tropical, 36(3): 288–296. |
| ○ |
Marquetti-Fernández, M. C., Saint-Jean, Y., Fuster-Callaba, C. A., González-Broche, R. & Leyva, M., 2013. Contribución al conocimiento de la distribución y aspectos biológicos de algunas especies de mosquitos en Haití. Anales de Biología, 35: 55–63. https://dx.doi.org/10.6018/analesbio.0.35.9 |
| ○ |
Mekuria, Y., Gwinn, T. A., Willians, D. C. & Tidwell, M. A., 1991. Insecticide susceptibility of Aedes aegypti from Santo Domingo, Dominican Republic. Journal of the American Mosquito Control Association, 7: 69–72. |
| ○ |
Mekuria, Y., Tidwell, M. A., Williams, D. C. & Mandeville, J. D., 1990. Bionomic studies of the Anopheles mosquitoes of Dajabon, Dominican Republic. Journal American Mosquito Control Association, 6: 651–657. |
| ○ |
Méndez, W., Liria, J., Navarro, J. C., García, C. Z., Freier, J. E, Salas, R., Weaver, S.C. & Barrera, R., 2001. Spatial dispersion of adult mosquitoes (Diptera: Culicidae) in a sylvatic focus of Venezuelan Equine Encephalites Virus. Journal of Medical Entomology, 38: 813–821. https://doi.org/10.1603/0022-2585-38.6.813 |
| ○ |
Monath, T. P., 1989. Yellow fever. In: Monath, T. P. (ed.). The arboviruses: ecology and epidemiology. Vol. 5. CRC Press. Florida: 139–231. |
| ○ |
Nayar, J. K., Rosen, L. & Knight, J. W., 1986. Experimental vertical transmission of Saint Louis encephalitis virus by Florida mosquitoes. American Journal of Tropical Medicine and Hygiene, 35: 1296–1301. https://doi.org/10.4269/ajtmh.1986.35.1296 |
| ○ |
O’Meara, G. F., Cutwa, M. M. & Evans, L. F. Jr., 2003. Bromeliad-inhabiting mosquitoes in south Florida: native and exotic plants differ in species composition. Journal of Vector Ecology, 28(1): 37–46. |
| ○ |
OMS. 2017. Enfermedades transmitidas por vectores. Disponible en: http://www.who.int/es/news-room/fact-sheets/detail/vector-borne-diseases [consultado 15 Jul. 2018]. |
| ○ |
OMS. 2018. Neglected tropical diseases. Mosquito-borne diseases. Disponible en: http://www.who.int/neglected_diseases/vector_ecology/mosquito-borne-diseases/en/ [consultado 15 Jul. 2018] |
| ○ |
ONAMET. 2018. Disponible en: http://onamet.gov.do/m/pdto/08w-wprono/01w-wpronostico-general.php [consultado 15 Jul. 2018] |
| ○ |
OPS. 2015. Salud en Las Américas. República Dominicana. Disponible en: https://www.paho.org/dor/index.php?option=com_content&view=article&id=44:salud-americas&Itemid=361 [consultado 15 Jul. 2018] |
| ○ |
Orgaz Agüera, F., 2014. Análisis del ecoturismo en República Dominicana: desarrollo sostenible. El caso del monumento natural Saltos de la Damajagua. Tesis Doctoral. Universidad de Sevilla. 249 pp. Disponible en https://idus.us.es/xmlui/handle/11441/56829 [consultado 15 Jul. 2018] |
| ○ |
Orgaz Agüera, F. & Cañero Morales, P., 2015. El ecoturismo como motor de desarrollo en zonas rurales: un estudio de caso en República Dominicana. Ciencia y Sociedad, 40(1): 47–76. Disponible en http://www.redalyc.org/articulo.oa?id=87038991004 [consultado 15 Jul. 2018] |
| ○ |
Paupy, C., Delatte, H., Bagny, L., Corbel, V. & Fontenille, D., 2009. Aedes albopictus, an arbovirus vector: from the darkness to the light. Microbes & Infection, 11: 1177–1185. https://doi.org/10.1016/j.micinf.2009.05.005 |
| ○ |
Peña, C. J., 1993. First report of Aedes (Stegomyia) albopictus (Skuse) from the Dominican Republic. Vector Ecology Newsletter, 24: 68. |
| ○ |
Peña, C. J. & Chadee, D. D., 2004. Mansonia dyari, Mansonia flaveola and Aedeomyia squamipennis in the Dominican Republic, three new country records. Journal of the American Mosquito Control Association, 20: 449–450. |
| ○ |
Peña, C. J. & Zaglul, A., 1986. Los mosquitos de la ciudad de Santo Domingo. Ciencia y Sociedad, 11(2): 178–187. https://doi.org/10.22206/cys.1986.v11i2.pp178–87 |
| ○ |
Pérez Vigueras, I., 1956. Los ixódidos y culícidos de Cuba, su historia natural y médica. Universidad de La Habana. La Habana. 579 pp. |
| ○ |
Pialoux, G., Gaüzère, B. A., Jaurèguiberry, S. & Strobel, M., 2007. Chikungunya, an epidemic arbovirosis. The Lancet Infectious Diseases, 7: 319–327. https://doi.org/10.1016/S1473-3099(07)70107-X |
| ○ |
Porter, J. E., 1967. A check list of the mosquitoes of the Greater Antilles and the Bahama and Virgin Islands. Mosquito News, 27: 3541. |
| ○ |
Pratt, H. D., 1946. The genus Uranotaenia Lynch Arribalzaga in Puerto Rico. Annals of the Entomological Society of America, 49: 556–584. https://doi.org/10.1093/aesa/39.4.576 |
| ○ |
Quintero, L. & Navarro, J. C., 2012. Filogenia intraespecífica y variabilidad genética de Culex quinquefasciatus Say (Diptera: Culicidae) con los genes mitocondriales ND5 y COI. Boletín de Malariología y Salud Ambiental, 52(1), 46–65. |
| ○ |
Rodríguez-Sosa, M. A., Vásquez-Bautista, Y. E., Fimia-Duarte, R., Guerrero, K. A. & Alarcón-Elbal, P. M., 2018. Primer registro de Uranotaenia cooki (Diptera: Culicidae) para República Dominicana. Revista Colombiana de Entomología, 44(1): 141–144. |
| ○ |
Rueda, J., Rodríguez Sosa, M. A., Vásquez Bautista, Y. E., Guerrero, K. A. & Alarcón-Elbal, P. M., 2018. Primera cita de Culex (Culex) garciai González Broche, 2000 (Diptera: Culicidae) para La Española. Anales de Biología, 40: 95–101. https://dx.doi.org/10.6018/analesbio.40.11 |
| ○ |
Scherer, W. F., Campillo-Sainz, C., Mucha-Macías, J. de, Dickerman, R. W., Wong Chia, C. & Zarate, M. L., 1971. Ecologic studies of Venezuelan encephalitis virus in Southeastern Mexico. The American Journal of Tropical Medicine and Hygiene, 21(1): 79–85. https://doi.org/10.4269/ajtmh.1971.20.989 |
| ○ |
Service, M. W., 1993. Mosquito ecology: field sampling methods. 2nd edition. Elsevier Science Publishers. Essex. 988 pp. |
| ○ |
Sinka, M. E., Rubio-Palis, Y., Manguin, S., Patil, A. P., Temperley, W. H., Gething, P. W., Boeckel, T. van, Kabaria, C. W., Harbach, R. E. & Hay, S. I., 2010. The dominant Anopheles vectors of human malaria in the Americas: occurrence data, distribution maps and bionomic précis. Parasites & Vectors, 3: 72. https://doi.org/10.1186/1756-3305-3-72 |
| ○ |
Spielman, A. & Weyer, A. E., 1965. Description of Aedes (Howardina) albonotatus (Coquillett), a common domestic mosquito from the Bahamas. Mosquito News, 25(3): 339–343. |
| ○ |
Tidwell, M. A., Williams, D. C., Carvalho Tidwell, T., Peña, C. J., Gwinn, T. A., Focks, D. A., Zaglul, A. & Mercedes, M., 1990. Baseline data on Aedes aegypti populations in Santo Domingo, Dominican Republic. Journal of the American Mosquito Control Association, 6: 514–522. |
| ○ |
Tsai, T. F. & Mitchell, C. J., 1989. St. Louis encephalitis. In: Monath, T. P. (edi.). The arboviruses: ecology and epidemiology. Vol. 5. CRC Press. Florida: 431–458. |
| ○ |
Turell, M. J., Dohm, D. J., Sardelis, M. R., O’Guinn, M. L., Andreadis, T. C. & Blow, J. A., 2005. An update on the potential of North American mosquitoes (Diptera: Culicidae) to transmit West Nile Virus. Journal of Medical Entomology, 42: 57–62. https://doi.org/10.1093/jmedent/42.1.57 |
| ○ |
Weger-Lucarelli, J., Rückert, C., Chotiwan, N., Nguyen, C., Garcia Luna, S. M., Fauver, J. R., Foy, B. D., Perera, R., Black, W. C., Kading, R. C. & Ebel, G. D., 2016. Vector competence of American mosquitoes for three strains of Zika virus. PLoS Neglected Tropical Diseases, 10: 1–16. https://doi.org/10.1371/journal.pntd.0005101 |
| ○ |
WRBU, 2018. Walter Reed Biosystematics Unit: Systematic catalog of Culicidae. Walter Reed Biosystematics Unit, Smithsonian Institution, Washington D.C. Disponible en: http://www.mosquitocatalog.org/ [consultado 15 Jul. 2018] |
| ○ |
Zavortink, T. J. & O’Meara, G. E., 1999. Culex (Micraedes) biscaynensis n. sp from Florida (Diptera: Culicidae). Journal of the American Mosquito Control Association, 15(3): 263–270. |
Fig. 1.— A. Anopheles albimanus, tórax, sedas 1-P y 2-P ancladas en un mismo tubérculo. B. Anopheles grabhamii, tórax, sedas 1-P y 2-P separadas, 1-P con ocho ramas. C–D. Culex atratus. C. Espículas del pecten de segmento VIII y detalle de una de ellas. D. Sifón, con detalle de varios dientes del pecten. E–G. Culex biscaynensis. E. Sifón. F. Espículas del pecten del segmento VIII y detalle de dos de ellas. G. Detalle de las espinas.