EL TAMAÑO, PERO NO LA FORMA, REFLEJARÍA DIFERENCIAS EN LAS
MANDÍBULAS DE DOS ESPECIES DE MURCIÉLAGOS DE HOJA NASAL (PHYLLOSTOMUS LACÉPÈDE, 1799) (CHIROPTERA, PHYLLOSTOMIDAE)
P. M. Parés-Casanova
Department de Ciència Animal, Universitat de Lleida, Av. Rovira Roure, 191, 25198 Lleida, Cataluña, España E-mail: peremiquelp@ca.udl.cat. ORCID iD: http://orcid.org/0000-0003-1440-6418
| |
RESUMEN
La mandíbula es un modelo para la evolución de las estructuras morfológicas complejas debido a que presenta una integración
del desarrollo de sus diferentes estructuras. A diferencia de otras partes del cráneo, que albergan estructuras con funciones
diferentes (protección del cerebro y de los órganos sensoriales), la principal demanda funcional para la mandíbula se relaciona
con la alimentación. Por ello, es esperable que sea la dieta su principal agente selectivo. En esta investigación se presenta
un estudio basado en morfometría geométrica, de mandíbulas pertenecientes a dos especies de murciélagos de hoja nasal, Phyllostomidae:
el murciélago nariz de hoja pálido (Phyllostomus discolor Wagner, 1843) (n= 29) y el murciélago nariz de hoja lanceolada [Phyllostomus hastatus (Pallas, 1767)] (n= 6), ambas especies omnívoras, con tendencia nectarívora. Las diferencias en tamaño y forma de la mandíbula
fueron examinadas usando 13 hitos anatómicos situados en la cara lateral de las hemimandíbulas. Los resultados revelaron diferencias
entre ambas especies para el tamaño, pero no para la forma, siendo insignificante la variación alométrica. Se concluye que
una alimentación parecida para ambas especies ha hecho evolucionar hacia una forma mandibular similar, aunque el tamaño para
ambas haya evolucionado de manera independientemente.
Palabras clave: alometría; Phyllostomidae; Phyllostomus discolor; Phyllostomus hastatus.
|
| |
ABSTRACT
Size, but not shape, would reflect mandibular differences in two spear-nosed bats (Phyllostomus Lacépède, 1799) (Chiroptera, Phyllostomidae)
The mandible is a model for the evolution of complex morphological structures because it presents a developmental integration
of its different parts. Unlike other parts of the skull that harbour different functions (protecting the brain and sensory
organs), the mandible’s main functional demands are related to feeding, and dietary changes are expected to be the main selective
agent for its structure. Here it is presented a geometric morphometric study of mandibles belonging to two species of New
World leaf-nosed bats, Phyllostomidae: Pale Spear-nosed Bat (Phyllostomus discolor Wagner, 1843) (n= 29) and Greater Spear-nosed Bat [Phyllostomus hastatus (Pallas, 1767)] (n= 6), both of them with an omnivorous with a nectarivorous shift feeding habit. Differences in size and
shape of mandible were examined using 13 landmarks plotted on lateral aspect. The results revealed species differences for
size but not for shape, being allometry an unimportant component of interspecific variation. It is concluded that similar
feeding specialization in both species would have evolved towards similar mandibular shape, with size having evolved quite
independently in both species.
Key words: allometry; Phyllostomidae; Phyllostomus discolor; Phyllostomus hastatus.
|
IntroducciónTOP
Existen buenas razones teóricas para esperar que animales que difieran en tamaño difieran también en forma, como respuesta
al principio simple que predice cambios en las proporciones como resultado de cambios en el tamaño (Pélabon et al., 2014). Se han publicado, en efecto, numerosísimos estudios que demuestran los cambios en la forma de los organismos según el tamaño.
En el caso de los mamíferos de Colombia, y para el caso concreto de los quirópteros, se han encontrado diferencias de tamaño
en varias especies (Rodríguez-Posada & Sánchez-Palomino, 2009), incluyendo las de la familia Phyllostomidae existentes en este país (Mantilla-Meluk et al., 2009).
Los filostómidos, los murciélagos de hoja nasal, se encuentran distribuidos a lo largo de América Central y del Sur, desde
México hasta el norte de Argentina, habiendo experimentado una radiación adaptativa sin precedentes en cuanto a su diversidad
ecológica y morfológica (Monteiro & Nogueira, 2011). Las adaptaciones que presentan los filostómidos son, efectivamente, de las más variadas y diversas dentro del orden Chiroptera,
siendo la especialización trófica la clave en su evolución (Monteiro & Nogueira, 2011). El género Phyllostomus Lacépède, 1799, que da nombre a la familia, está representado por cuatro especies de murciélagos de mediano a gran tamaño,
todas ellas registradas en Colombia: P. discolor Wagner, 1843, P. elongatus (É. Geoffroy, 1810), P. hastatus (Pallas, 1767) y P. latifolius (Thomas, 1901) (Mantilla-Meluk et al., 2009; Nogueira et al., 2009; Rodríguez-Posada & Sánchez-Palomino, 2009).
El murciélago nariz de hoja pálido (Phyllostomus discolor) oscila entre 89 y 109 mm de longitud total y se extiende desde Oaxaca y Veracruz (México) a Guayanas, sudeste de Brasil,
Bolivia, Paraguay, Perú y Venezuela (Kwiecinski, 2006). El murciélago nariz de hoja lanceolada (Phyllostomus hastatus) es claramente mayor, con una longitud total de aproximadamente 124-131 mm, y se encuentra ampliamente distribuido, pudiéndose
encontrar desde Honduras a Paraguay y sudeste de Brasil a Trinidad.
La diversidad trófica de los murciélagos se refleja en la diversidad estructural de su aparato masticatorio (Freeman, 1998; Dumont & Nicolay, 2006). Si las principales demandas funcionales de la mandíbula se relacionan con la alimentación, parecería que la dieta sería
su principal agente selectivo (Dumont & Nicolay, 2006). Phyllostomus discolor está descrita como una especie omnívora, con tendencia nectarí-vora (Kwiecinski, 2006), lo mismo que P. hastatus (Santos et al., 2003) y es este régimen alimentario el que explica la singular elongación del hocico en este género (Monteiro & Nogueira, 2011). Centramos pues este estudio en la variación del contorno de la mandíbula (tamaño y forma) en estas dos especies de Phyllostomus, de tamaño dispar pero régimen alimenticio similar, para saber si sus igualdades dietéticas han modelado formas mandibulares
distintas o no. O dicho de otro modo, la similitud de dietas entre P. hastatus y P. discolor se refleja en una igualdad de la forma de la mandíbula?
Material y métodosTOP
Recolección de datos. Se analizaron 35 mandíbulas pertenecientes a dos especies de Phyllostomus: P. discolor (n = 29: 9 ♂♂, 6 ♀♀ y 14 de sexo descono-cido) y P. hastatus (n = 6: 3 ♂♂, 2 ♀♀ y 1 de sexo desconocido) depositados en la colección del Instituto de Ciencias Naturales de la Universidad
Nacional de Colombia. Cada espécimen había sido identificado taxonómicamente hasta el nivel de especie y había sido recogido
para otros estudios, no llevándose pues a cabo ninguna captura ni sacrificio ex professo de animales para esta investigación. Los especímenes con puntos faltantes por un mal estado de conservación o por no ser
estos puntos poco claros fueron omitidos.
Obtención de puntos de referencia. Las fotografías digitales de las hemimandíbulas izquierda, por su cara lateral, se obtuvieron con una cámara digital Nikon
D1500 equipada con un teleobjetivo Nikon DX de 18-105 mm. En cada imagen fue incluido un patrón lineal de referencia. Las
imágenes se guardaron en formato jpg. Un total de 13 puntos de interés fue digitalizado utilizando el software de versión
2.21 TpsDig (Rohlf, 2010) (Fig. 1). Estos puntos de referencia elegidos, similares a los utilizados por otros autores en quirópteros (Mancina & Balseiro, 2010), estaban presentes en todas las muestras, y teniendo en cuenta que se reparten por toda la morfología de la cara lateral
del hemimandíbula, se consideró que engloban todas las unidades morfogenéticas mandibulares -alvéolos, apófisis y puntos de máxima curvatura-.
|
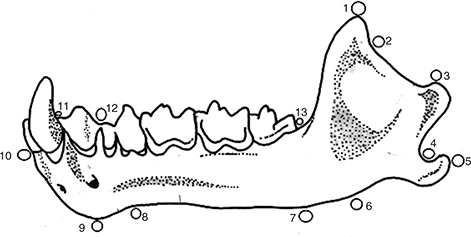 Fig. 1.— Mandíbula de Phyllostomus sp. mostrando los 13 hitos utilizados para capturar la forma y el tamaño. Fig. 1.— Mandíbula de Phyllostomus sp. mostrando los 13 hitos utilizados para capturar la forma y el tamaño.
Fig. 1.— Phyllostomus sp. mandible showing 13 landmarks used to capture form.
1 Punta del processus coronoides.
2 Punto de máxima concavidad de la incisura mandibulae.
3 Punto más dorsal del caput mandibulae.
4 Punto de máxima concavidad entre el punto más dorsal de la superficie condilar y el punto más caudal del proceso post-condilar.
5 Punto más caudal del proceso post-condilar.
6 Punto más ventral en la proyección perpendicular del extremo del proceso coronoide.
7 Punto más ventral en la proyección perpendicular del margen alveolar de la serie molar.
8 Proyección ventral perpendicular al punto más caudal del margen alveolar de la pM1.
9 Proyección ventral perpendicular al punto más rostral del margen alveolar de la pM1.
10 Punto más rostral de la mandíbula.
11 Punto más rostral del margen alveolar de pM1.
12 Punto más caudal del margen alveolar de pM1.
13 Punto más caudal de margen alveolar de la serie molar.
|
|
Para todas las muestras se obtuvo pues una serie de coordenadas cartesianas 2D (x, y) de cada uno de los 13 hitos estudiados.
Superposición de Procrustes. La forma fue obtenida de las coordenadas cartesianas originales estandardizando el tamaño de cada espécimen y reduciendo
al mínimo las diferencias translacionales y posicionales mediante un análisis generalizado de Procrustes (Gower, 1975). Muy sucintamente, el método consiste en ajustar cada espécimen a fin que la distancia entre cada punto cartesiano y el
centroide sea el mínimo (Webster & Sheets, 2010).
Análisis estadístico. Para obtener información sobre la forma, los datos fueron primero superpuestos mediante el paquete IMP CoordGen8 (Sheets, 1998). Utilizamos el tamaño de centroide (raíz cuadrada de las distancias al cuadrado sumadas de cada punto de referencia al centroide
de la configuración) (Swiderski, 2003) como una medida geométrica del tamaño de la mandíbula. Los vectores de lollipop, que fueron utilizados para presentar gráficamente el cambio medio en la dirección y significa la magnitud del desplazamiento
del punto de referencia, se obtuvieron con el software MorphoJ, versión 1.06c (Klingenberg, 2011).
Se utilizó el paquete TpsSmall, versión 1.29 (Rohlf, 2015) para evaluar la correlación entre las distancias 2D y las distancias euclidianas en el espacio tangente de la proyectada.
La correlación obtenida fue muy lineal para todos los datos (r = 1.000; pendiente b = 0.9993), lo que sugiere que el espacio tangente es una aproximación adecuada a Kendall y que ningún espécimen desviado
sensiblemente desde la línea de regresión lineal (Webster & Sheets, 2010). Así, aunque la mandíbula no es un objeto perfectamente coplanar, el autor considera que el enfoque bidimensional para su
estudio ha implicado una pérdida limitada de información. Se analizó la posible diferencia de forma entre sexos por medio
de un análisis multivariado de varianza NPMANOVA (Non-Parametric-Multivariate-ANalysis-Of-VAriance). Como no aparecieron diferencias
de forma entre machos y hembras (P. discolor: 9 ♂♂ y 6 ♀♀; P. hastatus: 3 ♂♂ y 2 ♀♀) para cada una de las especies estudiadas (p > 0.810) todos los ejemplares se agruparon para cada especie indepen-dientemente del sexo.
Análisis alométrico. La alometría estática denota cambios en la forma relacionada con el tamaño medidos en individuos diferentes en la misma
etapa de desarrollo dentro de una población o especie (Pélabon et al., 2014; Klingenberg, 2016). Para evaluar este efecto se exploraron los cambios en la forma versus el tamaño de centroide (datos logarítmicamente transformados) mediante una regresión multivariante. El paquete TpsRegr, versión
1.36 (Rohlf, 2015) fue utilizado para obtener esta regresión.
Comparación del tamaño y la forma. El tamaño de la mandíbula se comparó entre especies con la prueba U de Mann-Whitney, y el de la forma, con un test NPMANOVA con distancia de Mahalanobis. Para este análisis estadístico se recurrió
al paquete estadístico PAST, versión 2.17c (Hammer et al., 2001). El nivel de error tomado en cuenta para todas las pruebas estadísticas fue α = 0.05.
ResultadosTOP
Los valores promedios del tamaño de centroide fueron 360.23 y 502.21 para P. discolor y P. hastatus, respectivamente, reflejando la prueba de Mann-Whitney diferencias estadísticas en ambas especies (U = 4, p << 0.001) (Fig. 2). Pero no aparecieron diferencias en la forma, según reflejó el NPMANOVA (F = 0.007, p = 0,556) (Fig. 3). Los resultados de la regresión multivariante revelaron que la variación en la forma apenas se puede explicar por alometría
(test generalizado de Goodall: F = 0.502, grados de libertad = 26,858, p = 0.982), es decir, que el tamaño predice muy poco cambios en la forma.
|
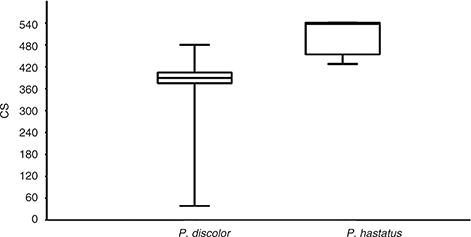 Fig. 2.— Comparación de tamaños (expresados como tamaño del centroide, CS) entre Phyllostomus discolor (n = 29) y P. hastatus (n = 6). La mediana se muestra con una línea horizontal dentro de la caja. Las líneas horizontales cortas en la parte superior/inferior
de la caja se sitúan a más/menos de 1,5 veces la altura de la caja de la caja. Los promedios del tamaño de centroide fueron
de 360,23 y 502,21 para P. discolor y P. hastatus, respectivamente. El test de Mann-Whitney reflejó diferencias estadísticamente significativas entre ambas especies (U = 4, p << 0.001). Fig. 2.— Comparación de tamaños (expresados como tamaño del centroide, CS) entre Phyllostomus discolor (n = 29) y P. hastatus (n = 6). La mediana se muestra con una línea horizontal dentro de la caja. Las líneas horizontales cortas en la parte superior/inferior
de la caja se sitúan a más/menos de 1,5 veces la altura de la caja de la caja. Los promedios del tamaño de centroide fueron
de 360,23 y 502,21 para P. discolor y P. hastatus, respectivamente. El test de Mann-Whitney reflejó diferencias estadísticamente significativas entre ambas especies (U = 4, p << 0.001).
Fig. 2.— Comparison of sizes (expressed as Centroid Size, CS) between Phyllostomus discolor (n = 29) and P. hastatus (n = 6). The median is shown with a horizontal line inside the box. The means of CS were 360.23 and 502.21 for P. discolor and P. hastatus, respectively. Mann-Whitney test reflected statistical differences between the two (U = 4, p << 0.001).
|
|
|
 Fig. 3.— Figuras lollipop para Phyllostomus discolor (n = 29) y P. hastatus (n = 6), que resumen gráficamente el cambio promedio en la dirección y la magnitud del desplazamiento de cada punto de referencia,
para ambas especies. El cambio en la forma mandibular se asocia con estructuras mandibulares como cóndilo, coronoides y angular
y la parte mental, pero no con la posición relativa y tamaño de las filas de los dientes. Fig. 3.— Figuras lollipop para Phyllostomus discolor (n = 29) y P. hastatus (n = 6), que resumen gráficamente el cambio promedio en la dirección y la magnitud del desplazamiento de cada punto de referencia,
para ambas especies. El cambio en la forma mandibular se asocia con estructuras mandibulares como cóndilo, coronoides y angular
y la parte mental, pero no con la posición relativa y tamaño de las filas de los dientes.
Fig. 3.— Lollipop plots for Phyllostomus discolor (n = 29) and P. hastatus (n = 6). They graphically summarize the mean change in direction and mean magnitude of landmark displacement for both species.
Mandibular shape is associated with structures such as condylar, coronoid and angular processes, and mental part, but not
with the relative position and sizes of tooth rows.
|
|
Así pues, el tamaño mandibular, pero no la forma, se mostró estadísticamente diferente entre P. discolor y P. hastatus. Dicho de otro modo, las mandíbulas están estructuradas del mismo modo entre las dos especies estudiada, quizás porque la
mecánica de la mordida sería similar en P. discolor y P. hastatus. Por otra parte, la alometría mandibular no apareció como un componente importante de la diferenciación entre ambas especies.
DiscusiónTOP
La morfometría se define como la descripción cuantitativa, el análisis y la interpretación del contorno (tamaño y forma) (Adams et al., 2013). Es un área fundamental de la investigación biológica, puesto que puede contribuir a la resolución de problemas taxonómicos
y funcionales.
La especialización en la dieta crea demandas funcionales singulares, lo que a su vez determina cambios en la biomecánica mandibular,
o sea que el comportamiento alimentario es relevante para entender la forma mandibular. En los filostómidos, está demostrado
que existen estos cambios mandibulares relacionados con la fuerza de la mordedura, como son el tamaño relativo de los procesos
mandibulares (coronoide y angular), la posición del arco cigomático y robustez, posición relativa y tamaño de las hileras
dentales, todos ellos con independencia del tamaño (Nogueira et al., 2009). Además, aunque la dimorfía sexual de la mandíbula podría representar una forma de reducir la competencia entre los sexos,
ya que permitiría a las hembras y los machos explotasen diferentes recursos tróficos, este dimorfismo no se ha detectado en
las dos especies por nosotros estudiadas. De todos modos, en la bibliografía hay casos en que se encuentra dimorfismo sexual
en la forma craneal (Power & Tamsitt, 1973; Willig, 1983; Willig & Hollander, 1995; Rodríguez-Posada & Sánchez-Palomino, 2009). La interpretación de los resultados de los análisis de variación sexual intraespecífica queda de todos modos sujeta a comprobaciones
con una muestra mayor y utilizando puntos anatómicos homólogos entre estudios.
En este estudio no se ha detectado tampoco ninguna diferencia en la forma mandibular entre las especies estudiadas, P. discolor y P. hastatus. Se explicaría ello porque los valores más altos en un rasgo se compensan con valores más bajos en otro, de lo que resulta
un equilibrio general en la forma, equilibrio que a la vez se justificaría por un uso alimentario no diferencial. Dicho de
otro modo: la presión selectiva trófica actuaría de manera uniforme en ambas especies.
En resumen: nos enfrentamos pues a una especialización de alimentación similar en Phyllostomus discolor y Phyllostomus hastatus, que requiere arquitectura funcional mandibular similar, aunque el tamaño haya evolucionado de forma independiente en ambas
especies.
Obviamente, para corroborar nuestras conclusiones serían interesantes estudios con más cantidad de ejemplares y con nuevas
técnicas, como la densitometría (aplicadas por Dumont & Nicolay, 2006). Así mismo, deberíamos ser conscientes que en este estudio hemos recurrido a la morfometría geométrica, que analiza distancias
entre puntos anatómicos discretos (Richtsmeier et al., 2002), por lo que la información obtenida ha sido en base a unas distancias determinadas, un subconjunto parcial de las posibles
distancias entre estos puntos, por lo que podrían haber muchas medidas redundante, mientras que otras medidas quedarían submuestreadas
o totalmente omitidas (Swiderski, 2003). Por consiguiente, la posible redundancia de las medidas contempladas y la omisión de los datos de forma independiente en
diferentes regiones pueden haber introducido pequeñas diferencias en lo que atañe a comparación con el trabajo de otros autores
referenciados, muchos de los cuales, por otro lado, han trabajado con morfometría lineal. De todos modos, puesto que no se
detecta alometría en el caso estudiado, tampoco no se consideraría que la posible existencia de variables dependientes entre
ellas haya podido representar una proporción exagerada de variación sesgada en la forma.
El presente trabajo es un primer paso para el estudio de las diferencias en la forma mandibular de estas dos especies de filostómidos,
Phyllostomus discolor y Phyllostomus hastatus, y su relación con la dieta, pero la inclusión de semilandmarks para cuantificar curvas y superficies sería de gran valor
para futuros trabajos sobre la estructura estudiada.
AgradecimientosTOP
Agradecemos a Catalina Cárdenas y Hugo Fernando López por facilitarnos el acceso a las colecciones del Instituto de Ciencias
Naturales de la Universidad Nacional de Colombia, en Bogotá, Colombia. También agradecemos a los revisores anónimos por sus
comentarios y sugerencias. No se recibió ninguna ayuda financiera para esta investigación.
ReferenciasTOP
| ○ |
Adams, D. C., Rohlf, F. J. & Slice, D. E., 2013. A field comes of age: geometric morphometrics in the 21st century. Hystrix, 24(1): 7–14. https://doi.org/10.4404/hystrix-24.1-6283 |
| ○ |
Dumont, E. R. & Nicolay, C. W., 2006. Cross-sectional geometry of the dentary in bats. Zoology, 109(1): 66–74. https://doi.org/10.1016/j.zool.2005.08.004 |
| ○ |
Freeman, P. W., 1998. Form, function, and evolution in skulls and teeth of bats. Papers in Natural Resources, 9: 140–156.
|
| ○ |
Gower, J. C., 1975. Generalized procrustes analysis. Psychometrika, 40(1): 33–51.
|
| ○ |
Hammer, Ø., Harper, D. A. T. & Ryan, P. D., 2001. PAST v. 2.17c. Palaeontologia Electronica, 4(1); 1–229.
|
| ○ |
Klingenberg, C. P., 2011. MorphoJ: An integrated software package for geometric morphometrics. Molecular Ecology Resources, 11(2): 353–357. https://doi.org/10.1111/j.1755-0998.2010.02924.x |
| ○ |
Klingenberg, C. P., 2016. Size, shape, and form: concepts of allometry in geometric morphometrics. Development Genes and Evolution, 226(3): 113–137. https://doi.org/10.1007/s00427-016-0539-2 |
| ○ |
Kwiecinski, G. G., 2006. Phyllostomus discolor. Mammalian Species, 801: 1–11. https://doi.org/10.1644/801.1 |
| ○ |
Mancina, C. A. & Balseiro, F., 2010. Variación en la forma de la mandíbula en Monophyllus redmani (Chiroptera: Phyllostomidae): análisis geométrico de la variación sexual y geográfica. Mastozoología Neotropical, 17(1): 87–95.
|
| ○ |
Mantilla-Meluk, H., Jimenez-Ortega, A. M. & Baker, R., 2009. Phyllostomid bats of Colombia: annotated checklist, distribution, and biogegography. Special Publications, Museum of Texas Tech University, 56: 1-37.
|
| ○ |
Monteiro, L. R. & Nogueira, M. R., 2011. Evolutionary patterns and processes in the radiation of phyllostomid bats. BMC Evolutionary Biology, 11: 137. https://doi.org/10.1186/1471-2148-11-137 |
| ○ |
Nogueira, M. R., Peracchi, A. L. & Monteiro, L. R., 2009. Morphological correlates of bite force and diet in the skull and
mandible of phyllostomid bats. Functional Ecology, 23(4): 715–723. https://doi.org/10.1111/j.1365-2435.2009.01549.x |
| ○ |
Pélabon, C., Firmat, C., Bolstad, G. H., Voje, K. L. & Houle, D., 2014. Evolution of morphological allometry. Annals of the New York Academy of Sciences, 1320: 58–75. https://doi.org/10.1111/nyas.12470 |
| ○ |
Power, D. M. & Tamsitt, J. R., 1973. Variation in Phyllostomus discolor (Chiroptera: Phyllostomatidae). Canadian Journal of Zoology, 51(4): 461–468. https://doi.org/10.1139/z73-069 |
| ○ |
Richtsmeier, J. T., DeLeon, V. B. & Lele, S. R., 2002. The promise of geometric morphometrics. Yearbook of Physical Anthropology, 45: 63–91. https://doi.org/10.1002/ajpa.10174 |
| ○ |
Rodríguez-Posada, M. E. & Sánchez-Palomino, P., 2009. Taxonomía del género Phyllostomus (Chiroptera: Phyllostomidae) en Colombia. Mastozoologia Neotropical, 16(1): 153–168. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0327-93832009000100013 [consultado, 22.10.2018].
|
| ○ |
Rohlf, F. J., 2010. Digitalized Landmarks and Outlines. Stony Brook. New York. Disponible en http://life.bio.sunysb.edu/morph/soft-dataacq.html [consultado, 22.10.2018].
|
| ○ |
Rohlf, F. J., 2015. The tps series of software. Hystrix, 26(1): 9–12. https://doi.org/10.4404/hystrix-26.1-11264 |
| ○ |
Santos, M., Aguirre, L. F., Vázquez, L. B. & Ortega, J., 2003. Phyllostomus hastatus. Mammalian Species, 722: 1–6. https://doi.org/10.1644/0.722.1 |
| ○ |
Sheets, H. D., 1998. IMP: CoordGen8-Coordinate Generation Utility. Canisius College. Buffalo. Disponible en http://www3.canisius.edu/~sheets/CoordGenManual.htm [consultado, 22.10.2018].
|
| ○ |
Swiderski, D. L., 2003. Separating size from allometry: analysis of lower jaw morphology in the fox squirrel, Sciurus niger. Journal of Mammalian Evolution, 84(3): 861–876. https://doi.org/10.1644/BRB-025 |
| ○ |
Webster, M. & Sheets, H. D., 2010. A practical introduction to landmark-based geometric morphometrics. The Palaeontological Society Papers, 16: 163–188.
|
| ○ |
Willig, M. R., 1983. Composition, microgeographic variation, and sexual dimorphism in Caatingas and Cerrado bat communities
from northeastern Brazil. Bulletin of Carnegie Museum of Natural History, 23: 1–131.
|
| ○ |
Willig, M. R. & Hollander, R. R., 1995. Secondary sexual dimorphism and phylogenetic constraints in bats: a multivariate approach.
Journal of Mammology, 76(4): 981–992. https://doi.org/10.2307/1382592 |
Fig. 1.— Mandíbula de Phyllostomus sp. mostrando los 13 hitos utilizados para capturar la forma y el tamaño.