LOS HEMERÓBIDOS DE LA PENÍNSULA IBÉRICA Y BALEARES (INSECTA, NEUROPTERIDA, NEUROPTERA: HEMEROBIIDAE)
Víctor J. Monserrat
Departamento de Zoología y Antropología Física, Facultad de Biología, Universidad Complutense, 28040 Madrid (España)
E-mail: artmad@bio.ucm.es
| |
RESUMEN
Se revisan las especies de hemeróbidos presentes en la fauna de la Península Ibérica e Islas Baleares donde, hasta la fecha,
está representada por 40 especies pertenecientes a 7 géneros. Tras una diagnosis de la familia y algunos elementos sobre su
historial paleontológico y su distribución, se aportan unos datos generales sobre su morfología y su biología, sus estadios
juveniles y comportamiento, y se comenta una breve introducción sobre la historia en el conocimiento de la familia, y en particular
en la Península Ibérica y Baleares. Se incluye una lista de las especies pertenecientes a su fauna, una clave de identificación
de los géneros, subgéneros y especies citadas en la Península Ibérica y Baleares, y una clave de sus larvas a nivel genérico.
De cada una de estas especies se recopilan y se anotan todas las referencias bibliográficas existentes relativas a las especies
de la zona estudiada, tanto con la denominación actualmente aceptada, como de sus sinonimias y/o cualquier otra combinación
nomenclatural bajo las cuales han sido citadas. También de cada una de las especies se anotan los datos conocidos y los ahora
anotados sobre su distribución general, aspectos de su morfología externa y genital, así como de su variabilidad, estadios
juveniles, biología, fenología y distribución altitudinal y geográfica en la península y archipiélago balear, en base a un
total de 5.338 ejemplares estudiados y aportando nuevo material inédito de 10 especies (con 341 nuevos ejemplares estudiados).
Palabras clave: Insecta;
Neuroptera;
Hemerobiidae;
Revisión;
Taxonomía;
Faunística;
Morfología;
Península Ibérica;
Islas Baleares;
España;
Portugal;
Andorra.
|
| |
ABSTRACT
The brown-lacewings from the Iberian Peninsula and Balearic Islands
The present contribution revises the brown-lacewing species included in the fauna of the Iberian Peninsula and Balearic Islands
which, to date, is represented by 40 species belonging to 7 genera. After a diagnosis of the family and its paleontological
history and distribution, some general data on its morphology and biology, juvenile stages and behavior are examined, and
a brief introduction on knowledge of the history of the family, particularly in the Iberian Peninsula and Balearic Islands,
is considered. A list of relevant species, an identification key to the genera, subgenera and species recorded in the Iberian
Peninsula and Balearic Islands, and a general key to their larval stages, are included. For each species present in the study
area, all existing bibliographic references, both with the currently accepted name, their synonyms and/or any other nomenclatorial
combinations under which they have been recorded, are reviewed and anotated. Also considered for each species are the present
general distribution, and both the known and new recorded data of external and genital morphology, as well as their variability,
juvenile stages, biology, phenology and altitudinal and geographic distribution in the Peninsula and Balearic Archipelago,
on the basis of 5.338 studied specimens, including new unrecorded material for 10 species (with 341 newly studied specimens).
Key Words: Insecta;
Neuroptera;
Hemerobiidae;
Revision;
Taxonomy;
Faunistics;
Morphology;
Iberian Peninsula;
Balearic Islands;
Spain;
Portugal;
Andorra.
|
IntroducciónTOP
Anotamos en este primer apartado unas generalidades introductorias sobre la diagnosis de esta familia, su historial paleontológico
y distribución, algunos datos generales sobre su biología, comportamiento, estadios juveniles y ciclos biológicos, y un breve
historial sobre su taxonomía y sistemática y su progresivo conocimiento en la Península Ibérica y Baleares.
Generalidades: diagnosis, historial paleontológico y distribución
Los hemeróbidos constituyen una interesante familia de neurópteros (Figs. 1-12), debido a su amplia distribución geográfica, al elevado número de individuos que frecuentemente constituyen sus poblaciones,
y especialmente por su utilización como agentes de control de pequeños artrópodos fitófagos (New, 1975a, 1975b, 1988c, 1999, 2001, 2002; McEwen et al., 2001). No obstante, es proporcionalmente escasa la atención que vienen recibiendo en comparación con otras familias de neurópteros
de interés en el control biológico, sea Coniopterygidae y especialmente Chrysopidae, y son proporcionalmente escasos los datos
existentes sobre la distribución, la biología, fenología, morfología, estadios juveniles y variabilidad de la mayoría de sus
especies (Oswald, 1988a, 1988b, 1990, 1993a, 1993b, 1994, 1996; Makarkin, 1990; Monserrat, 1990a, 1990b, 1990c, 1990d, 1991b, 1993, 1994, 1996a, 1998, 2000, 2001, 2002, 2003, 2004, 2008a; Monserrat & Deretsky, 1999; New, 2001; Hölzel, 2007; Monserrat et al., 2013b; Devetak, 2014, etc., por citar algunos de los más recientes).
|
 Figs. 1-12.— Hemeróbidos en su ambiente: 1-2: Sympherobius fallax; 3: Megalomus sp., probablemente M. hirtus; 4: Hemerobius gilvus; 5: Megalomus sp., probablemente M. tineoides; 6: Micromus angulatus; 7: Micromus variegatus; 8: Hemerobius micans; 9: Micromus angulatus; 10: Wesmaelius subnebulosus; 11: Drepanepteryx phalaenoides; 12: Wesmaelius quadrifasciatus. Fotos 1-4 y 6 de Isidro Martínez; 5 de Francisco Rodríguez (http://faluke.blogspot.com.es/search/label/neuroptera); 7 y 9 de José Ramón Pato (http://www.faunayflora.net/index.php); 8 de Santiago Pagola; 10 de José Ignacio L. Colón; 11 de Johannes Gepp & Edith Winkler; 12 de Johannes Gepp (tomada de
Gepp, 1999). Figs. 1-12.— Hemeróbidos en su ambiente: 1-2: Sympherobius fallax; 3: Megalomus sp., probablemente M. hirtus; 4: Hemerobius gilvus; 5: Megalomus sp., probablemente M. tineoides; 6: Micromus angulatus; 7: Micromus variegatus; 8: Hemerobius micans; 9: Micromus angulatus; 10: Wesmaelius subnebulosus; 11: Drepanepteryx phalaenoides; 12: Wesmaelius quadrifasciatus. Fotos 1-4 y 6 de Isidro Martínez; 5 de Francisco Rodríguez (http://faluke.blogspot.com.es/search/label/neuroptera); 7 y 9 de José Ramón Pato (http://www.faunayflora.net/index.php); 8 de Santiago Pagola; 10 de José Ignacio L. Colón; 11 de Johannes Gepp & Edith Winkler; 12 de Johannes Gepp (tomada de
Gepp, 1999).
Figs. 1-12.— Habitus of brown-lacewings in their habitats: 1-2: Sympherobius fallax; 3: Megalomus sp., probably M. hirtus; 4: Hemerobius gilvus; 5: Megalomus sp., probably M. tineoides; 6: Micromus angulatus; 7: Micromus variegatus; 8: Hemerobius micans; 9: Micromus angulatus; 10: Wesmaelius subnebulosus; 11: Drepanepteryx phalaenoides; 12: Wesmaelius quadrifasciatus. Fotographs 1-4 and 6 by Isidro Martínez; 5 by Francisco Rodríguez (http://faluke.blogspot.com.es/search/label/neuroptera); 7 and 9 by José Ramón Pato (http://www.faunayflora.net/index.php); 8 by Santiago Pagola; 10 by José Ignacio L. Colón; 11 by Johannes Gepp & Edith Winkler; 12 by Johannes Gepp, from Gepp (1999).
|
|
Por muchos caracteres morfológicos, anatómicos y biológicos, los hemeróbidos son muy próximos a los crisópidos (New, 1989), quienes junto a los osmílidos y sisíridos son su grupo hermano, y junto a otras familias pertenecen al suborden de los
Hemerobiiformia, uno de los grandes y más extensos y diversos linajes que constituyen los Neuroptera s.str. (= Planipennia) Handlirsch, 1908 (Aspöck, 1992, 1993, 1995, 1996; H. Aspöck et al., 2001; U. Aspöck et al., 2001; Nel et al., 2003; Aspöck & Aspöck, 1999, 2010, 2013; Winterton et al., 2010; Tauber & Adams, 1990; Beutel et al., 2010; Aspöck et al., 2012; etc.), y que junto a los Raphidioptera Latreille, 1810 y los Megaloptera Latreille, 1810 forman el Superorden Neuropterida
o Neuroptera s. l., que en su conjunto está constituido por unas 6550 especies repartidas en estos tres órdenes citados y habitualmente reconocidos:
Megaloptera (c. 310 spp.), Raphidioptera (c. 239 spp.) y Planipennia o Neuroptera s. str. (c. 6000 spp.) (Aspöck et al., 1980, 1991; H. Aspöck et al., 2001), cuyas relaciones aún son objeto de amplios debates (ej.: Whiting et al., 1997; Ren & Hong, 1994; U. Aspöck et al., 2001; Winterton, 2003; Haring & Aspöck, 2004; Winterton et al., 2010; Haring et al., 2011; Aspöck et al., 2012; Peters et al., 2014, etc.).
Dentro de esta familia cerca de 30 géneros actuales son conocidos y su taxonomía ha sido en varias ocasiones subdividida en
clasificaciones que no han sido posteriormente asumidas (New, 1989; Oswald, 1993a, 1994), sea Sympherobiidae/resto: Hemerobiidae (Comstock, 1918) o Notiobiellinae/resto: Hemerobiinae (Nakahara, 1960a). Hoy día se aceptan las subfamilias: Adelphohemerobiinae Oswald, 1994 (un género de Chile), Hemerobiinae Latreille, 1802 (cinco géneros, en conjunto de distribución cosmopolita), Sympherobiinae Comstock, 1918 (tres géneros de distribución cosmopolita, salvo Australia), Carobiinae Oswald, 1993 (un género de Australia), Psychobiellinae
Oswald, 1993 (un género de Australia), Notiobiellinae Nakahara, 1960 (cuatro géneros, en conjunto de distribución cosmopolita),
Dreapanacrinae Oswald, 1993 (tres géneros de distribución neotropical, S.E. Asia, Australia, Nueva Zelanda y Pacífico sur),
Megalominae Krüger, 1922 (un género de Eurasia, África, Norte- y Sudamérica), Drepanepteryginae Krüger, 1922 (tres géneros de Eurasia, África y Sudamérica) y Microminae Krüger, 1922 (cuatro géneros, en conjunto de distribución cosmopolita) (Krüger, 1922; Oswald, 1993a, 1994; Monserrat & Deretsky, 1999; H. Aspöck et al., 2001; Monserrat, 2008a; New, 2001). Para los interesados en conocer información sobre sus géneros y especies se recomienda Oswald (2013a).
La familia está formada por unas 600 especies actuales que se consideran válidas (Monserrat, 1990c; Oswald, 1993a), y está representada en la fauna del Paleártico Occidental (desde Macaronesia, Norte de África y Europa a Oriente Medio,
Cáucaso e Irán) por c. 64 especies (Aspöck, 1992; H. Aspöck et al., 2001). La Fauna Ibérico-Balear posee representantes de todos los géneros de esta familia presentes en la Fauna neuropterológica
Europea, y es particularmente rica en especies de neurópteros, ya que nada menos que 197 especies están presentes en su fauna:
Megaloptera (3 spp.), Raphidioptera (16 spp.) y Planipennia o Neuroptera s. str. (178 spp.), representando en varias familias entre el 100% a más del 75% del total de especies europeas conocidas, y en
el caso de la familia que tratamos incluye el 75,47% de las especies europeas, con 40 especies confirmadas en su fauna (Figs. 1-12), de las 53 especies válidas hoy citadas en Europa (Aspöck et al., 1980, 1991; Aspöck, 1992; Aspöck & Hölzel, 1996; H. Aspöck et al., 2001; Monserrat, 2011; Monserrat & Triviño, 2013; Monserrat et al., 2013b), algunas endémicas y otras únicamente citadas en ella dentro del Continente Europeo.
La familia Hemerobiidae ha sido definida desde Krüger (1922) y Tillyard (1916) a Oswald (1993a), quien realiza un análisis cladístico de sus géneros, aportando una clave de géneros (imagos) y definiendo sus relaciones
filogenéticas.
Esta familia (Figs. 1-12) tiene como caracteres diagnósticos, entre otros, la presencia de cabeza pequeña, hipognata, fuertemente esclerificada (puede
presentar áreas membranosas sobre la frente en algunos géneros como Neosympherobius), y porta dos grandes ojos compuestos, negros o cobrizos, ampliamente lateralizados, en especies de alta montaña a veces
reducidos (Monserrat, 2004) y sin ocelos presentes (Fig. 13). En estado de reposo la cabeza está con frecuencia flanqueada por la región basal de las alas anteriores que la protegen
(Drepanepteryx, Megalomus) (Fig. 11). Las antenas son moniliformes, generalmente algo más cortas que las alas anteriores (Hemerobius, Wesmaelius, Micromus), algo más largas en Psectra, y menor de la mitad de la longitud de las alas anteriores en Drepanepteryx (Figs. 1-11), poseen escapo grande, aplanado dorsoventralmente y grueso, generalmente convexo hacia la línea media interior y pedicelo
normalmente mayor que el primer flagelómero (Fig. 13) y el número de flagelómeros es variable (45-65), a veces con modificaciones sexuales. Aparato bucal masticador con mandíbulas
asimétricas portadoras de un dentículo interno (más desarrollado en la izquierda), palpo maxilar formado por 5 o 6 artejos
y labial por 3 o 4 (Fig. 13).
|
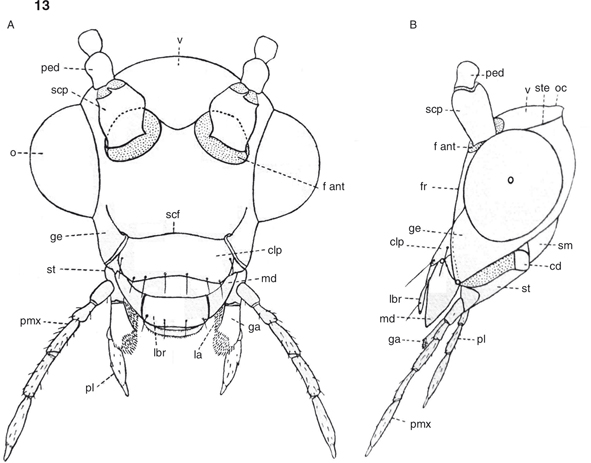 Fig. 13.— Terminología cefálica de Wesmaelius quadrifasciatus, adaptada de Killington (1936). A: vista anterior, B: vista lateral. cd: cardo; clp: clípeo; ga: galea; ge: gena; f ant: foramen antenal; fr: frente; la:
lacínea; lbr: labro; md: mandíbula; o: ojo; oc: occipucio; ped: pedicelo; pl: palpo labial; pmx: palpo maxilar; scf: sutura
clípeo-frontal; scp: escapo; sm: submentum; st: estipe; ste: sutura temporal; v: vértex. Fig. 13.— Terminología cefálica de Wesmaelius quadrifasciatus, adaptada de Killington (1936). A: vista anterior, B: vista lateral. cd: cardo; clp: clípeo; ga: galea; ge: gena; f ant: foramen antenal; fr: frente; la:
lacínea; lbr: labro; md: mandíbula; o: ojo; oc: occipucio; ped: pedicelo; pl: palpo labial; pmx: palpo maxilar; scf: sutura
clípeo-frontal; scp: escapo; sm: submentum; st: estipe; ste: sutura temporal; v: vértex.
Fig. 13.— Head Terminology of Wesmaelius quadrifasciatus, adapted from Killington (1936). A: from front, B: from side. cd: cardo; clp: clypeus; ga: galea; ge: gena; f ant: antennary foramen; fr: frons; la: lacinia;
lbr: labrum; md: mandible; o: eye; oc: occiput; ped: pedicel; pl: labial palpus; pmx: paxillary palpus; scf: clypeo-frontal
suture; scp: scape; sm: submentum; st: stipe; ste: temporal suture; v: vertex.
|
|
El tórax es compacto, piloso, de similar color que el resto del tegumento, aunque frecuentemente porta una banda media dorsal
más pálida. Protórax con pronoto transverso, generalmente más ancho que largo, a veces más alargado y/o con expansiones laterales,
el mesotórax suele estar más desarrollado que el metatórax (Figs. 1-11). Las alas están bien desarrolladas, en las alas anteriores su longitud oscila entre los 3 y los 18 mm, son subiguales, ovoides,
a veces elípticas o alargadas (Figs. 1-10, 14, 40-54, 88-97), a veces marcadamente falcadas en su extremo e incluso de aspecto festoneado, imitando hojas secas (Drepanepteryx, Megalomus, Micromus, Gayomyia, Megalomina, Drepanacra) (Figs. 11, 98), y ocasionalmente, especialmente en poblaciones isleñas o de alta montaña o en especies adaptadas a medios más edáficos,
hay reducción en las alas posteriores (Figs. 15, 99) con ejemplares braquípteros, micrópteros o dimórficos, con ejemplares machos o hembras macrópteros o braquípteros (Nusalala, Psectra, Micromus, Hemerobius, Conchopterella, Pseudopsectra, Nesothauma, etc.) y/o algo más esclerificadas y ocasionalmente algo más coriáceas, incluso fusionadas o pinchosas las anteriores (Perkins, 1899; McClendon, 1906; Mjöberg, 1910; Killington & Kimmins, 1932; Killington, 1936; Tjeder, 1936b; Carpenter, 1940; Zimmerman, 1946, 1957; Lems, 1952; MacLeod, 1960b; Penny & Sturm, 1984; Simon et al., 1984; New, 1966, 1986, 1989, 2001; Monserrat, 1992a, 2004; Oswald, 1996; Hollier et al., 1997; Tauber et al., 2007). En estado de reposo normalmente adoptan la típica posición tectiforme o “en tejadillo” (Figs. 1-11), aunque algunos géneros (Notiobiella, Annandalia) aplican las alas sobre el substrato, quizás como método defensivo para evitar sombras y pasar más inadvertidos (New, 1986). Mayoritariamente la membrana y la venación alar es, como el tegumento, de tonos pardos (ocasionalmente en algunas especies
de algunos géneros como Notiobiella es verde), siendo frecuentes bandas, manchas y sombras más oscuras sobre ella o su nerviación (Figs. 1-11, 52-54, 91-99), con frecuencia está irregularmente pigmentada con zonas más oscuras y otras más pálidas, y a veces (ej.: en géneros Wesmaelius, Sympherobius, Megalomus, Megalomina, Gayomyia, Drepanacra, Carobius, Micromus) existe una gran variabilidad en la pigmentación, incluso dentro de la misma especie (ej.: se han descrito unas 17 formas,
a veces como especies distintas, en función de la coloración de Drepanacra binocula), y sobre ella la setación es normalmente abundante (con microtrichias sobre la membrana y macrotrichia sobre la venación),
tricosoros presentes (pequeños espesamientos sobre la vena costal situados entre los extremos de las bifurcaciones distales
de las venas longitudinales) (Figs. 14, 88-99) y carecen de nygmata (pequeños puntos cuticulares oscuros que pueden aparecer en las alas anteriores, posteriores, o en
ambas en algunas familias de neurópteros). El perostigma es de presencia variable según géneros y especies, generalmente poco
conspicuo. La venación de las alas anteriores se caracteriza por la fusión por un tramo del Radio y su Sector (Fig. 14) y la presencia de dos o más (hasta 12) ramas del Radio, frecuentemente llama-dos Sectores del Radio (SR en el texto), en
número variable: normalmente 2 en Sympherobius y Psectra, 3 en Hemerobius, entre 3 y 5 en Wesmaelius [3 (muy ocasionalmente 4) en W. (Kimminsia) y 4 (a veces 5) en W. (Wesmaelius)], 6-7 en Megalomus y 10 o más en Drepanepteryx (Figs. 14, 15, 40-54, 88-99). Venillas transversales (gradiformes) generalmente en dos hileras oblícuas (en Psectra 1, en Drepanepteryx 3), en número variable según los géneros (incluso dentro de la misma especie). Venas Sc y R no fusionadas en sus extremos.
En las alas anteriores el campo costal es de extensión variable, normalmente con venillas bifurcadas y en la mayoría de los
géneros la vena humeral es recurrente y encierra la llamada ventana oval (Figs. 14, 32). En otros géneros (Micromus, Psectra) la venilla humeral es similar a las restantes venas transversales del campo costal (Figs. 15, 31). Portan un desarrollado lóbulo yugal en la región anal (Fig. 14), aunque en el vuelo las alas no se encuentran acopladas. En las alas posteriores este campo costal está menos desarrollado
y posee venillas no bifurcadas, normalmente poseen un único Sector del Radio, y SR y R no coalescentes (Figs. 14, 40-54, 88-99), sus venillas transversales son mucho menos frecuentes, y generalmente portan frénulo desarrollado (Fig. 14). A veces (Psectra) están reducidas o son prácticamente inexistentes (Figs. 15, 99), indistintamente en machos o en hembras y/o las anteriores están más quitinizadas. Las patas son marchadoras (Figs. 1-10), las anteriores suelen ser algo más pilosas, las coxas son libres, los fémures son cilíndricos, y las tibias están comprimidas
lateralmente y ensanchadas en su zona media, las patas posteriores son más largas, y suelen portar alguna patente espina terminal.
Tarsos de 5 segmentos, más largo el basal, también portando pequeñas espinas terminales, que utilizan para la locomoción y
el aseo, y finaliza en dos uñas tarsales curvas y simples y con empodio presente.
|
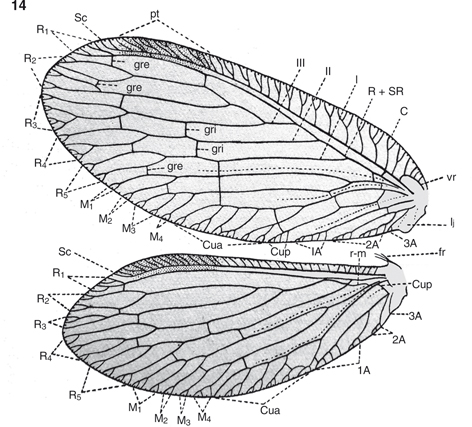 Fig. 14.— Terminología alar de Hemerobius humulinus, adaptada de Killington (1936). A: anal; C: costal; Cua: cubital anterior; Cup: cubital posterior; fr: frénulo; gre: gradadas externas; gri: gradadas internas;
lj: lóbulo yugal; M: mediana; pt: pterostigma; R: radio; Sc: subcostal; SR: sector del radio; vr: vena recurrente; I, II,
III: sectores del radio. Fig. 14.— Terminología alar de Hemerobius humulinus, adaptada de Killington (1936). A: anal; C: costal; Cua: cubital anterior; Cup: cubital posterior; fr: frénulo; gre: gradadas externas; gri: gradadas internas;
lj: lóbulo yugal; M: mediana; pt: pterostigma; R: radio; Sc: subcostal; SR: sector del radio; vr: vena recurrente; I, II,
III: sectores del radio.
Fig. 14.— Wing terminology of Hemerobius humulinus, adapted from Killington (1936). A: anal; C: costal; Cua: anterior cubital; Cup: posterior cubital; fr: frenulum; gre: outer gradate; gri: inner gradate;
lj: jugal lobe; M: median; pt: pterostigma; R: radius; Sc: subcostal; SR: radial sector; vr: recurrent veinlet; I, II, III:
radial sectors.
|
|
|
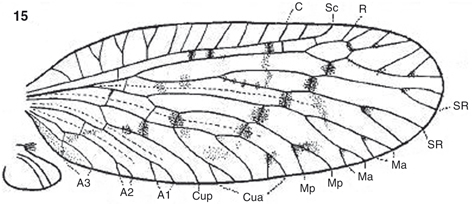 Fig. 15.— Terminología alar de Psectra diptera (ejemplar braquiptero), adaptada de Killington (1936). A: anal; C: costal; Cua: cubital anterior; Cup: cubital posterior; Ma: mediana anterior; Mp: mediana posterior; R: radio;
Sc: subcostal; SR: sector del radio. Fig. 15.— Terminología alar de Psectra diptera (ejemplar braquiptero), adaptada de Killington (1936). A: anal; C: costal; Cua: cubital anterior; Cup: cubital posterior; Ma: mediana anterior; Mp: mediana posterior; R: radio;
Sc: subcostal; SR: sector del radio.
Fig. 15.— Wing terminology of Psectra diptera (brachypterous specimen), adapted from Killington (1936). A: anal; C: costal; Cua: anterior cubital; Cup: posterior cubital; Ma: anterior median; Mp: posterior median; R: radius;
Sc: subcostal; SR: radial sector.
|
|
El abdomen está formado por diez segmentos claramente separados, con tergos y esternos bien diferenciados y amplias áreas
pleurales, 8 pares de estigmas en los 8 primeros segmentos y de mayor diámetro el más próximo al tórax, y los segmentos distales
están sexualmente especializados, con callo cercal y tricobotrias presentes y estructuras genitales externas e internas bien
desarrolladas en los ♂♂, con elementos característicos que se exponen en cada género (Figs. 55-77, 100-117), y frecuentemente estructuras subgenitales y siempre ausencia de ovopositor en las ♀♀ (Figs. 78-87). Al margen de la terminalia y genitalia, ocasionalmente se ha descrito dimorfismo sexual en la morfología antenal, ocular,
elementos de la cápsula cefálica, tamaño y venación alar, etc. (New, 1988a, 1989; Makarkin & Kholin, 1995; Monserrat, 1998).
Sobre sus estadios juveniles, y a pesar de su interés en el terreno de la Entomología Aplicada, sus fases larvarias han despertado
menor atención que en otras familias, especialmente Chrysopidae, y solo existen datos para 9 de los cerca de 30 géneros conocidos
(Oswald, 1993a; Oswald & Tauber, 2001). Aunque hablaremos de ellas en el apartado sobre la biología en esta familia, adelantemos en esta introducción que las larvas
son depredadoras de huevos y larvas de insectos y de pequeños artrópodos como ácaros, arañas, insectos fitófagos de tegumento
blando, etc., y son de tipo campodeiforme, de vida libre sobre la vegetación, a veces edáfica o corticícola (Figs. 12, 19-28). Tras tres estadios, la fase larvaria madura que se dispone a pupar, tras tejer el capullo, adopta una posición quiescente
y curvada en fase de prepupa antes de transformarse en pupa (Fig. 28). La pupa es activa, dectica y exarada (Fig. 30). En el siguiente apartado anotamos más detallados datos (más información general o curiosa en: Killington, 1936, 1937; New, 1968b; Samson & Blood, 1980; Mansell, 1986; Gepp, 1990, 1999; Tauber & Krakauer, 1997; Oswald & Tauber, 2001).
Su historial paleontológico no es extenso, y es relativamente reciente, aunque familias probablemente cercanas (†Palaemerobiidae,
†Sialidopseidae, †Permegalomidae) del Pérmico Superior representarían unos de los registros más antiguos asignables a Neuroptera
(14 familias fósiles frente a 19 familias actuales, citaba Schlüter, 1986). Los registros más antiguos asignables a la familia que nos ocupa corresponden a †Promegalomus anomalus del Jurásico superior de Kazakstán y †Mesohemerobius jeholensis del Cretácico inferior de China (hoy dudosamente asignado a esta familia), †Purbemerobius medialis del Cretácico inferior inglés (tentativamente asignado a esta familia), y †Cretomerobius disjunctus del Cretácico de Mongolia, y otros taxa del Cretácico inferior brasileño, pero son escasos los registros durante el Mesozoico.
Por el contrario, en el Terciario parecen más abundantes, con registros de imagos y larvas en el ámbar báltico del Eoceno
(†Prolachlanius resinatus, †Prospadobius moestus, †Prophlebonema resinata, †Sympherobius completus) (†Hemerobites antiquus, inicialmente asignado a esta familia, ha sido transferido al orden Isoptera), así como del Oligoceno-Eoceno inglés, danés
y norteamericano de la Columbia Británica y del Mioceno dominicano y del Cáucaso (†Notiobiella thaumasta, †Bothromicromus lachlani, †Cretomerobius wehri, †Drepanepteryx oedobia, †D. ramosa, †Hemerobius incertus, †H. prohumulinus, †H. tinctus, †Megalomus caucasicus, †M. maculosus, †M. densistriatus, †M. sikhotensis, †Wesmaelius mathewesi, etc.), así como otros taxa de posición más incierta. Más información sobre este particular en Hagen (1856), Scudder (1878), Brauer (1886), Handlirsch (1906-1908), Henriksen (1922), Krüger (1922), Ping (1928), Martynova (1952, 1961), MacLeod (1970), Larsson (1978), Jarzembowski (1980), Panfilov (1980), Panfilov (1980), Schlüter (1986), Oswald (1990, 1993a, 1994, 1999), Aspöck et al. (1991), Makarkin (1991a), Carpenter (1992), Ponomarenko (1992), Ren & Hong (1994), Rumbucher (1995), Weitschat & Wichard (1998), Oswald (1999), Grimaldi (2000), Grimaldi et al. (2002), Makarkin et al. (2003, 2012), Grimaldi & Engel (2005), Engel & Grimaldi (2007, 2008), Jepson & Penney (2007), Makarkin & Wedmann (2009), Jepson et al. (2010, 2012), etc.
La familia tiene una distribución cosmopolita (salvo la Antártida) y es especialmente abundante en medios tropicales, subtropicales
y templados, evitando en general medios más adversos, aunque son numerosas las especies adaptadas a medios subdesérticos
y xéricos más extremos, así como a zonas boreales más frías y/o de alta montaña (hasta los 4000 m) que han generado numerosos
endemismos y distribuciones relictas y fragmentadas (Klingstedt, 1931; Carpenter, 1938; Kaisila, 1952; Schedl, 1970; Greve, 1984; Kevan & Klimaszewski, 1986; Popov, 2002b). También, y como no, posee representantes en la fauna europea de especies invasoras de otros continentes. Ejemplos de todo
ello tenemos en nuestra fauna, según indicaremos en cada caso.
Datos generales sobre su biología, comportamiento, estadios juveniles y ciclos biológicos
Los hemeróbidos (Figs 1-12) son insectos a veces muy abundantes (Dunn, 1954), pero poco frecuentes, que suelen pasar desapercibidos en la Naturaleza, al tratarse de un grupo de pequeño tamaño, generalmente
poco llamativos, y frecuentemente con escasa capacidad de vuelo (New, 1967b). En condiciones naturales óptimas, a veces parecen presentar cierta capacidad de agregación, concentrándose numerosos ejemplares
en muy pequeño espacio, aunque normalmente son más escasos y sus poblaciones están más dispersas.
Sobre su biología anotemos que los imagos son, mayoritariamente, insectos de actividad crepuscular/nocturna, iniciando su
actividad de vuelo entre las 18-20 h, finalizando al amanecer, con máxima actividad entre las 22-23 h, aunque no permanecen
inactivos durante las horas del día, curiosamente aumentan su actividad antes de una tormenta (Killington, 1936; Banks, 1952; Ábrahám & Vas, 1999; Vas et al., 1999; Szentkirályi, 2001a; Ábrahám & Mészáros, 2006), pero algunos géneros (Psectra) presentan marcada actividad diurna (New, 1966). Con tiempo frío reducen notablemente su actividad. Se mueven mucho por la vegetación, pero vuelan poco y generalmente en
cortos trayectos, y son marcadamente sedentarios en las especies con reducción alar (Psectra, Conchopterella, Nusalala, etc.). Tanto machos como hembras son atraídos por fuentes de luz artificial (Williams & Killington, 1935; Killington, 1936; Andersen & Greve, 1975; Zelený, 1984; Honěk & Kocourek, 1986; New, 1989; Günther, 1991; Greve & Kobro, 1998, 2009; Szentkirályi, 1992, 1997; Ábrahám et al., 2003; Reichholf, 2005a, 2005b; Penny et al., 2007, etc.), y algunos géneros como Micromus o Megalomus se han recolectado mayoritariamente con este medio. Con frecuencia han sido citados como transportados por el viento, incluso
a largas distancias y/o elevaciones, y algunos estudios han demostrado una sorprendente capacidad de dispersión, con capturas
hasta a 200 m sobre el nivel del suelo, e incluso mar adentro (Greve, 1969; Hardy & Cheng, 1986; Sugg et al., 1994; Monserrat et al., 1999; Szentkirályi, 2001a; Chapman et al., 2004), y cómo no, trasladados por los medios de transporte humanos (Monserrat, 1996a) (ver más adelante Hemerobius bolivari).
La coloración disruptiva, críptica o marcadamente mimética de sus alas, a veces imitando hojas (Morton, 1910; Faúndez, 2005) (Figs. 1-11, 91-99), les sirve de defensa pasiva en las zonas bien de umbría, bien agostadas o bien arenosas donde habitualmente se encuentran,
y como hemos indicado, en algunos géneros (Notiobiella, Annandalia) las alas están capacitadas para aplicarse sobre el sustrato, evitando sombras y haciéndolos menos visibles a los depredadores,
y estos mecanismos de defensa están asociados a particulares comportamientos de defensa activos ante situaciones de peligro
muy extendidos en esta familia, al plegar las alas, recoger entre ellas cabeza, antenas y patas, dejarse caer al sustrato,
y adoptar por un tiempo un comportamiento de tanatosis y así disuadir o mitigar el interés del potencial depredador (Killington,
1946; New, 1986). Ocasionalmente se ha citado mimetismo con especies de otros órdenes de insectos (ej.: Drepanepteryx phalaenoides con Drepana lacertinaria Linnaeus, 1758, Lepidoptera: Drepanidae) (Morton, 1910).
Aunque se ha demostrado la ingesta de néctar y polen, los imagos de Hemerobiidae son depredadores generalistas de pequeños
artrópodos fitófagos de movimientos lentos y tegumento blando, especialmente homópteros: áfidos, aleiródidos y cóccidos, también
jásidos, psíllidos, trips, psocópteros, arañas, ácaros, larvas de otros insectos (ocasionalmente se han hallado escamas de
mariposas en su tubo digestivo), etc. (Cole, 1925, 1933; Killington, 1936; Stelzl, 1990, 1991, 1992; Monserrat, 1994), en proporción a su morfología, estadio y tamaño. Canard, 2001: 122 aporta una recopilación de las presas citadas, y New, 1975a, 1976b, 1984, 1986, 1988c, 1999, 2001, 2002; Neuenschwander et al., 1975; Neuenschwander & Hagen, 1980; Szabó & Szentkirályi, 1981; Duelli, 2001; Horne et al., 2001; Stelzl & Devetak, 1999; Szentkirályi, 2001a, 2001b, 2001c; Pantaleoni, 2001; Senior & McEwen, 2001; Pantaleoni & Alma, 2001; McEwen et al., 2001; Lara & Perioto, 2003; Miller et al., 2004; Monserrat, 2008a; Devetak, 2014, entre otros muchos, comentan su interés aplicado en cultivos e intereses humanos, y por ello son excelentes aliados de nuestros
intereses contra estos dañinos insectos, y de hecho, algunas especies exóticas se han introducido en numerosos países para
su utilización como agentes de control de determinadas plagas (ejs. Micromus timidus en Hawái o Sympherobius gayi en Nigeria), y por ello son motivo de multitud de artículos de Entomología Aplicada, y aunque citaremos algunos que nos competen,
escapan a la intención de esta contribución.
Durante la alimentación suelen ayudarse con las patas anteriores para sujetar mejor a sus presas mientras la devoran, y el
aseo de antenas, piezas y palpos bucales y patas anteriores es obligado tras cada ingesta (Killington, 1946; Monserrat, 2003). Sin duda la mayor o menor longitud de sus piezas bucales está en función del tamaño y la capacidad de moción de sus presas
(New, 1986). La localización de sus presas a través de sus kairomonas y feromonas ha sido frecuentemente registrada, y sobre ellas pueden
llegar a ser extremadamente voraces (Withycombe, 1925; Dunn, 1954; Miermont, 1973; Miermont & Canard, 1975; New, 1984, 1988c, 1989, 2001; Dey & Bhattacharya, 1997; Mendel et al., 1997, 2004; Nelson et al., 2001; Szentkirályi, 2001a; Canard & Volkovich, 2001; Branco et al., 2006a, 2006b, etc.), habiéndose registrado, por citar algunos ejemplos, imagos de Hemerobius pacificus devorando 25 pulgones diarios o en H. stigma, consumos de 13.000-17.000 (huevos y ninfas) de adélgidos a lo largo de sus dos meses de vida (Laidlaw, 1936), de 5-15 cóccidos diarios en Sympherobius maculipennis, o de 10 pulgones al día en Micromus posticus (Canard, 2001), con una media de 70-75 pulgones consumidos a lo largo de su vida larvaria (Withycombe, 1925; Dunn, 1954), o 315 áfidos durante sus nueve semanas de vida (Killington, 1936), y Neuenschwander et al. (1975) y Neuenschwander & Hagen (1980) aportan interesantes datos sobre este particular en H. pacificus. Se calcula que la descendencia de una pareja de hemeróbidos puede consumir 4 × 106 áfidos en un año (New, 1988c).
En ocasiones (Figs. 2, 4) han sido observados sobre flores (Knuth, 1909; Killington, 1936; Bugg, 1987) y muchas especies parecen ser más omnívoras, pues ingieren polen y néctar, o se han hallado levaduras, hifas y esporas de
hongos en su tubo digestivo, que complementan su dieta o la sustituyen en ausencia de presas (Stelzl & Gepp, 1987; Stelzl, 1990, 1991, 1992; Monserrat, 1994, 1996a, 1997, 1998, 2000, 2003, 2008a; Robinson et al., 2008), y se han hallado restos de dípteros o escamas de mariposas, hechos que no parecen casuales (Monserrat, 1997, 2000, 2003; Canard, 2001). No existe canibalismo, pero en ocasiones las ♀♀ en cautividad, particularmente si son vírgenes, devoran sus propios huevos
recién puestos (Miermont & Canard, 1975; New, 1986).
En ocasiones algunas de nuestras especies parecen ser verdaderamente estenotópicas en relación al tipo de substrato vegetal
elegido y, consecuentemente, a las potenciales presas que se hallan sobre él (Hemerobius nitidulus, H. micans, H. contumax, H. pini, H. stigma, Micromus angulatus, Sympherobius fuscescens, Wesmaelius quadrifasciatus, W. ravus, W. helveticus, etc.) (Stroyan, 1949; Monserrat & Marín, 1996a, 1996b), hecho que limita su distribución, y muestran una marcada especificidad en sus presas (estenofagia), hecho que, entre otros
elementos ambientales, les genera indirectamente una marcada especificidad en el tipo de medio y plantas substrato sobre el
que los hallamos, sean coníferas, planifolios, vegetación herbácea, etc. Otras especies, por el contrario, son más euritópicas,
dentro de una amplia gama de plantas, si bien particulares de determinados ambientes o hábitats (Hemerobius humulinus, H. gilvus, H. lutescens, Sympherobius elegans, S. pygmaeus, Wesmaelius malladai, etc.), mientras que otras son declaradamente generalistas (Wesmaelius subnebulosus) (Carpenter, 1940; Nakahara, 1954; Yang, 1980a; New, 1984, 1986; Gepp, 1999; Monserrat & Marín, 1996a, 1996b, 2001). Se ha demostrado una estratificación de las diferentes especies en función de la altura del dosel arbóreo/vegetal (New, 1967b; Nielsen, 1977; Zelený, 1984; Hollier & Belshaw, 1993; Sziráki, 1996; Szentkirályi, 2001a, 2001b, 2001c; Duelli et al., 2002, etc.).
Curiosamente, en la bibliografía general, e incluso en relación a la fauna europea en particular, no existen muchos datos
sobre el comportamiento de los individuos durante el cortejo y la cópula (Canard & Volkovich, 2001). Killington (1931, 1936) describe el de Sympherobius fuscescens, en el que los machos en presencia de hembras receptivas agitan las antenas y extienden parcialmente las alas sobre la horizontal.
Se han detectado órganos sensoriales de captación de vibraciones (rango de frecuencia de 300-2.000 Hz) en las tibias (Devetak, 1998), por lo que la comunicación acústica debe realizar una importante misión. Riek (1967) cita estructuras alares y abdominales en esta familia con posibles funciones estridulatorias, y también la emisión de feromonas
(Szentkirályi, 2001a) interviene en el proceso de contribuir a la localización y comunicación de los ejemplares. Tras unos segundos de tocamientos
de las antenas, el macho gira y se coloca paralelo a la hembra acercando su extremo abdominal al suyo, produciéndose la cópula
(Yadav et al., 2009). El macho acaba en posición opuesta, pudiendo ser arrastrado por la hembra en su desplazamiento. En este género (Sympherobius) se ha detectado un pequeño espermatóforo blanco que la hembra devora poco después de la cópula (Killington, 1931, 1936), pero este acto (curvar el abdomen, sujetarlo con las patas y acercar la boca al orificio genital) ha sido observado en
otros géneros (Carpenter, 1940; Tjeder, 1963a), con lo que se deduce la existencia generalizada de espermatóforo. Ocasionalmente se ha observado más de una cópula a lo
largo de la vida de las hembras (Miermont & Canard, 1975).
La longevidad de los imagos está condicionada por factores ambientales (fotoperiodo, humedad relativa, temperatura, cantidad
de alimento, etc.) y si las condiciones son favorables es proporcionalmente elevada para insectos de este tamaño, pudiendo
alcanzar varios meses de vida (Canard & Volkovich, 2001), no existiendo apreciables diferencias entre los ♂♂ y las ♀♀, aunque Carpenter (1940) o Laffranque & Canard (1975) citan a las ♀♀ más longevas y, consecuentemente, más abundantes en las capturas (New, 1967b). Otros datos son opuestos, y así Banks (1952) anota mayor número de machos que de hembras en capturas seriadas mediante trampas de succión (quizás por tener una mayor
actividad), y Miller & Cave, 1987 anotan una mayor longevidad en machos (45-100 días) frente a las hembras (25-86 días) de Micromus posticus. Por citar otros ejemplos, hay datos de hasta 147 días de vida (media 72 días) en Hemerobius pacificus a 19,3 °C, de entre 55-93 días a 25 °C en Nusalala uruguaya, de 90-175 días a 20 °C en Micromus angulatus, o de hasta 48-53 días a 20 °C y de 13 días a 25 °C en Wesmaelius subnebulosus (Neuenschwander, 1975, 1976; Laffranque & Canard, 1975; Souza, 1988; Canard & Volkovich, 2001). Por citar otros ejemplos, Rivnay (1943) anota diferentes longevidades de hasta 40 días en Sympherobius en función de diferentes condiciones ambientales, New (1966) anota hasta 82 días de vida en ♀♀ de Psectra diptera, y New (1984) aporta interesantes datos en especies australianas con longevidades de 16-34, 17-32, 25-58 y 19-43 días a 25 °C, también
Withycombe (1922b) anota longevidades en alguna de nuestras especies, de 8 semanas para H. stigma y de dos meses para S. pygmaeus, y Killington (1936) de 8-9 semanas en M. hirtus y S. fuscescens, Monserrat (2003) cita 14-22 días para Hemerobius bolivari, 20 días para H. chilensis, 28-41 días para Gayomyia falcata y 10-42 días para Sympherobius gayi (y 25 días hemos observado y ahora citamos en hembras de Sympherobius fallax), y Sato & Takada (2004) ofrecen diferencias en los tiempos de desarrollo y longevidad de imagos (hasta 55 días) en función de la temperatura de
tres especies del género Micromus, y otros datos son aportados por Miermont (1973), Miermont & Canard (1975), Neuenschwander et al. (1975), New (1975c), Yadav et al. (2008, 2009, 2010) para otras especies.
Los imagos neonatos requieren de unos días para que sus gónadas maduren antes de iniciar su fase reproductora (New, 1984; Canard & Volkovich, 2001). La trasferencia de esperma merced al espermatóforo ha sido escasamente observada, aunque sí demostrada, y es conocido que
la hembra lo devora pocos días después de la cópula (Killington, 1931).
Tras la cópula, la puesta de huevos comienza, en condiciones experimentales, desde pocas horas a varios días, pudiéndose prolongar
durante unos pocos días a semanas, incluso meses. Los sustratos elegidos, a veces muy selectivos, suelen ser el envés y márgenes
de las hojas (así lo hemos observado y ahora citamos en Sympherobius fallax), cortezas, base de las acículas, etc., a veces próximos a las colonias de futuras potenciales presas, bien aislados (generalmente
adheridos al sustrato sobre su superficie longitudinal) o en pequeños grupos (generalmente adheridos al sustrato merced a
secreciones de las glándulas de cemento y quedan fijados sobre su polo dorsal, nunca el micropilar, que es el último en salir
de las vías genitales femeninas) (Cutright, 1923; Killington, 1936; Fulmek, 1941; De Montmollin, 1978; Monserrat, 1983a, 2003; Vidya et al., 2008). A veces las hembras son muy selectivas a la hora de depositar sus huevos (Miermont & Canard, 1975 citan de 138 a 983 huevos puestos según diferentes sustratos ofrecidos a hembras de Micromus angulatus, y De Montmollin, 1978 ofrece interesantes datos al respecto en Wesmaelius subnebulosus). Duelli (1986) sugiere en Micromus variegatus indicios de huevos pedunculados como los que hallamos en Chrysopidae, Berothidae, Mantispidae, etc., como mecanismos de defensa
ante la predación, hecho que nos parece meramente accidental.
Los huevos son fusiformes, elípticos o levemente arriñonados, algo más del doble de largos (según géneros europeos de 0,42-1,00
mm) que de diámetro, de extremos redondeados (Fig. 16), de color crema o amarillo pálido, a veces rosados, verdosos o blancos muy pálidos (así lo hemos observado y ahora citamos
en Sympherobius fallax), color que va cambiando conforme el desarrollo embrionario progresa, apareciendo las bandas metaméricas pardas y los estemas
más oscuros, y el progresivo oscurecimiento del huevo los hace menos conspicuos. En algunos géneros (Hemerobius) resisten el frío o hibernan en esta fase (Garland, 1978, 1980; Kevan & Klimaszewski, 1987). Poseen micropilo aparente, a veces blanco muy llamativo, y poseen frecuentes esculturas sobre el corion y dispersos aeropilos
(Figs. 16, 17) (Smith, 1923; Withycombe, 1925; Killington, 1936, 1946; Carpenter, 1940; Miller & Lambdin, 1982; New & Boros, 1983; Miller & Cave, 1987; Gepp, 1990, 1999; Oswald, 1993a; Oswald & Tauber, 2001; Monserrat, 2008b), que le dan al huevo, incluso a simple vista, un aspecto aterciopelado.
En condiciones experimentales se han citado en diferentes especies puestas de entre 6-41 huevos diarios y puestas de 1-25,
30-40, 53-379, 154, 206, 252, 280, 298-1484, 457, 460, 500, 619, 898, 1045, 1450, 1500-2300 y 2554 huevos por hembra (Williams, 1927; Killington, 1936; Laidlaw, 1936; Rivnay, 1943; Canard, 1975; Laffranque & Canard, 1975; Miermont & Canard, 1975; Neuenschwander, 1975, 1976; New, 1984, 1988c; Miller & Cave, 1987; Canard & Volkovich, 2001; Monserrat, 2003), y lógicamente la fertilidad no solo depende de las condiciones ambientales, sino de su alimentación y del propio tamaño de las hembras (Attia & El Arnaouty, 2008; Yadav et al., 2010). Generalmente la puesta se efectúa a lo largo de varios días, habitualmente en dos fases separadas por un periodo de descanso (Miermont & Canard, 1975 citan periodos de puesta de 16-20 días en Micromus angulatus, Miller & Cave, 1987 citan 21-79 días para Micromus posticus con puestas de hasta 58 huevos diarios, Monserrat, 2003 cita puestas de 19, 36 y 5 huevos a lo largo de 14 días en Hemerobius bolivari, de 6 y 3 huevos en 6 días en Nomerobius cuspidatus, y de entre 5-28 huevos en Sympherobius gayi), aunque especies de más amplia fenología (ej. H. stigma) mantienen huevos fértiles por mucho más tiempo (Killington, 1936). En algunos géneros (Psectra) se ha observado oofagia (Killington, 1946; New, 1966, 1986).
Lógicamente el tiempo de desarrollo del huevo varía en función de la temperatura, oscilando entre 3,5 y 25 días (Cutright, 1923; Smith, 1923; Killington, 1936; Rivnay, 1943; Dunn, 1954; New, 1966; Miermont & Canard, 1975; Syrett & Penman, 1981; Monserrat, 1983a, 2003; Miller & Cave, 1987; Canard & Volkovich, 2001), y 6 días hemos observado y ahora citamos en Sympherobius fallax. Killington (1932b, 1932c, 1936, 1937, 1946) anota los tiempos de desarrollo embrionario en diferentes especies británicas, y Sato & Takada (2004) en varias especies japonesas del género Micromus. La ruptura del huevo es mediante una incisión en Y longitudinal y se realiza merced al concurso de un ovirruptor embrional aserrado (Fig. 18) (Smith, 1922, 1923; Withycombe, 1925; Killington, 1936, 1946; Frankenberg, 1937; New, 1975c; New & Boros, 1983; Monserrat, 1983a, 2003) que queda adherido al tegumento (clípeo-labro) embrionario y al corion abandonado. El proceso del nacimiento es detalladamente descrito por Killington (1936).
Las larvas neonatas permanecen unas horas sobre/junto al huevo antes de iniciar su actividad, y presentan tres estadios de similares morfologías, solo el primer estadio posee empodio en sus tarsos, y obviamente varían en tamaño y quetotaxia según los géneros, y en general las mayores diferencias inter-específicas se manifiestan en larvas de tercer estadio. El proceso de la ecdisis es detalladamente descrito por Killington (1936). Las larvas son de tipo campodeiforme (Fig. 12), generalmente alargadas, desnudas (que no se cubren con elementos foráneos) y muy activas (Bänsch, 1964), especialmente en el primer estadio, y son depredadoras de pequeños fitófagos, especialmente áfidos, aleiródidos y cóccidos, aunque otros muchos grupos han sido citados entre sus presas (adélgidos, taumastocóridos, filoxéridos, etc.), siendo, también en este estadio, excelentes aliados contra estos fitófagos (McEwen et al., 2001), y a veces son muy selectivas (Kawashima, 1958; Hussein, 1985), elemento que contribuye a la especificidad de sustrato sobre los que a veces hallamos los imagos. Se desplazan ayudándose (haciendo palanca) con el extremo del abdomen y mueven lateralmente la cabeza a uno y otro lado buscando sus presas. Atacan a sus presas sin aparentemente elegir una posición determinada, y mientras la succionan dirigen los palpos hacia abajo y arquean las antenas hacia atrás (Killington, 1936; Monserrat, 1983a, 2003). A veces se ha observado canibalismo (Smith, 1923; New, 1975b). Pueden llegar a ser, también en estas fases juveniles, extremadamente voraces, habiéndose citado, por ejemplo en H. stigma, consumos de 3.000 huevos y larvas de adélgidos a lo largo de su desarrollo (Laidlaw, 1936), 350 áfidos para alcanzar la pupación en H. pacificus (Moznette, 1915a, 1915b) o de 79 áfidos en H. nitidulus, 69-88 en W. betulinus, o 75-96, 315 áfidos en M. hirtus (Withycombe, 1923; Killington, 1936). También devoran otros artrópodos depredadores, y por ejemplo Quayle (1913) cita larvas de Hemerobius californicus devoradoras de 532/897 arañas durante sus 17/20 días de desarrollo. Obviamente el número y tipo de presas consumidas va a estar condicionada por el tamaño/sexo/longevidad del individuo (Miermont, 1973; Laffranque, 1973; Laffranque & Canard, 1975; Attia & El Arnaouty, 2008), e influirá en su potencial reproductor (Hussein, 1984; Canard, 2001). Se ha anotado una mortalidad en su desarrollo de hasta el 50% (Dunn, 1954).
Presentan cabeza pequeña y antenas relativamente largas formadas por tres segmentos, al igual que los palpos labiales (Figs. 12, 19-28), y tienen piezas bucales típicas de Neuropteroidea, Hemerobiiformia, con mandíbulas curvas, levemente dentadas hacia el ápice y de longitud variable según los géneros, y maxilas curvadas, no dentadas y con canal alimentario entre mandíbulas-maxilas por donde succionan los líquidos de sus presas (Withycombe, 1925; Killington, 1936; Gaumont, 1976), y el palpo labial es trisegmentado de longitud variable. Poseen seis estematas (Paulus, 1986) y la quetotaxia cefálica es característica de cada género, utilizándose en su diagnosis. Frecuentemente la cabeza se encuentra parcialmente embutida en la parte anterior del tórax, y el orificio bucal está clausurado por el tegumento. Las patas son marchadoras, con tarsos cortos acabados en un par de curvas uñas y sólo en el primer estadio finalizan en un empodio en forma de embudo. El tórax es sencillo y el abdomen consta de diez segmentos, ambos sin especial ornamentación, setación, tubérculos, ni mayor especialización (que junto a la ausencia de empodios en 2° y 3° estadio suele distinguirlas, entre otros caracteres, de las a veces parecidas larvas de crisópidos, que también poseen mandíbulas-maxilas curvas), salvo los últimos que van adelgazándose (Figs. 12, 19-28) y frecuentemente se utilizan, a modo de palanca sobre el sustrato, para favorecer la locomoción (así lo hemos observado y ahora citamos en Sympherobius fallax) y para segregar sustancias defensivas, que también son utilizadas para fijar la larva por este extremo al sustrato durante la ecdisis (Killington, 1936, 1946; Monserrat, 2003). El último segmento posee dos pequeñas estructuras eversibles bilobuladas (Withycombe, 1925) que contribuyen a la locomoción.
|
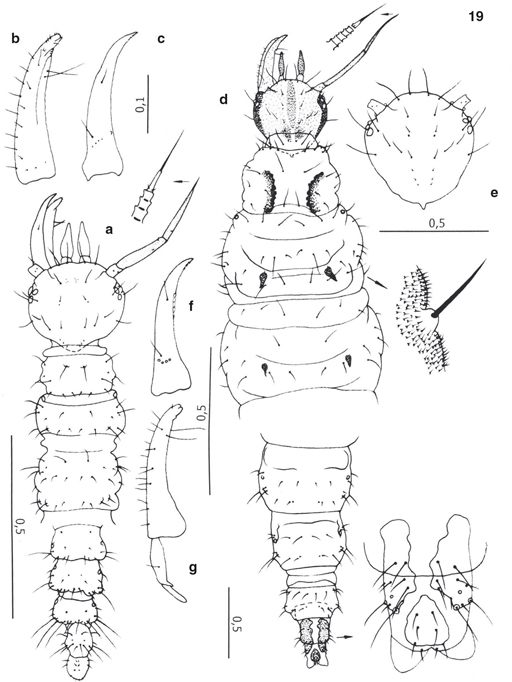 Fig. 19.— Estadios juveniles de Hemerobius bolivari, según Monserrat (2003): a: región anterior y posterior de la larva neonata, vista dorsal (ampliado extremo antenal), b: maxila, vista dorsal, c: mandíbula, vista dorsal, d: región anterior y posterior de la larva madura, vista dorsal (ampliado extremo antenal, quetotaxia y porción caudal), e: cápsula cefálica, vista dorsal, f: mandíbula, vista dorsal, g: maxila, vista dorsal. Escala en mm para todas las figuras. Fig. 19.— Estadios juveniles de Hemerobius bolivari, según Monserrat (2003): a: región anterior y posterior de la larva neonata, vista dorsal (ampliado extremo antenal), b: maxila, vista dorsal, c: mandíbula, vista dorsal, d: región anterior y posterior de la larva madura, vista dorsal (ampliado extremo antenal, quetotaxia y porción caudal), e: cápsula cefálica, vista dorsal, f: mandíbula, vista dorsal, g: maxila, vista dorsal. Escala en mm para todas las figuras.
Fig. 19.— Juvenile stages of Hemerobius bolivari, from Monserrat (2003): a: anterior and posterior regions of neonate larva, dorsal view (magnified antenal apex), b: maxilla, dorsal view, c: mandible, dorsal view, d: anterior and posterior regions of mature larva, dorsal view (magnified antenal apex, chaetotaxy and caudal portion), e: cephalic capsule, dorsal view, f: mandible, dorsal view, g: maxilla, dorsal view. Scale in mm for all figures.
| |
|
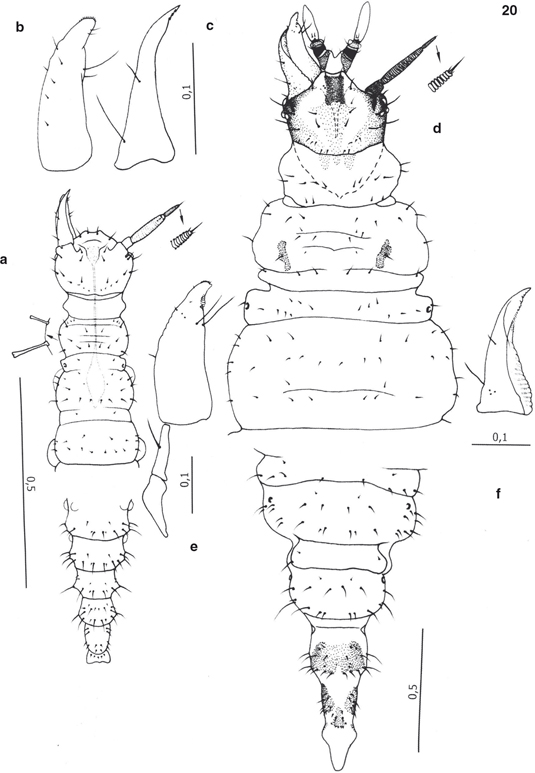 Fig. 20.— Estadios juveniles de Sympherobius gayi, según Monserrat (2003): a: región anterior y posterior de la larva neonata, vista dorsal (ampliado extremo antenal y algunas setas), b: maxila, vista dorsal, c: mandíbula, vista dorsal, d: región anterior y posterior de la larva madura, vista dorsal (ampliado extremo antenal), e: maxila, vista dorsal, f: mandíbula, vista dorsal. Escala en mm para todas las figuras. Fig. 20.— Estadios juveniles de Sympherobius gayi, según Monserrat (2003): a: región anterior y posterior de la larva neonata, vista dorsal (ampliado extremo antenal y algunas setas), b: maxila, vista dorsal, c: mandíbula, vista dorsal, d: región anterior y posterior de la larva madura, vista dorsal (ampliado extremo antenal), e: maxila, vista dorsal, f: mandíbula, vista dorsal. Escala en mm para todas las figuras.
Fig. 20.— Juvenile stadies of Sympherobius gayi, from Monserrat (2003): a: anterior and posterior regions of neonate larva, dorsal view (magnified antenal apex and some setae), b: maxilla, dorsal view, c: mandible, dorsal view, d: anterior and posterior regions of mature larva, dorsal view (magnified antenal apex), e: maxilla, dorsal view, f: mandible, dorsal view. Scale in mm for all figures.
| |
|
 Figs. 21-28.— Vista dorsal de larvas maduras de 21: Micromus paganus, 22: Micromus variegatus, 23: Wesmaelius quadrifasciatus, 24: Megalomus fidelis, 25: Psectra diptera, 26: Drepanepteryx phalaenoides, 27: Hemerobius simulans, 28: Wesmaelius navasi (omitidas las patas). 21-23, según Veenstra et al. (1990); 24, según MacLeod (1960a); 25, según Killington (1946); 26, según Morton (1910); 27, según Killington (1932b); 28, según Monserrat (1983a). A diferentes escalas. Figs. 21-28.— Vista dorsal de larvas maduras de 21: Micromus paganus, 22: Micromus variegatus, 23: Wesmaelius quadrifasciatus, 24: Megalomus fidelis, 25: Psectra diptera, 26: Drepanepteryx phalaenoides, 27: Hemerobius simulans, 28: Wesmaelius navasi (omitidas las patas). 21-23, según Veenstra et al. (1990); 24, según MacLeod (1960a); 25, según Killington (1946); 26, según Morton (1910); 27, según Killington (1932b); 28, según Monserrat (1983a). A diferentes escalas.
Figs. 21-28.— Third-instar larvae of 21: Micromus paganus, 22: Micromus variegatus, 23: Wesmaelius quadrifasciatus, 24: Megalomus fidelis, 25: Psectra diptera, 26: Drepanepteryx phalaenoides, 27: Hemerobius simulans, 28: Wesmaelius navasi (legs omitted). 21-23 from Veenstra et al. (1990); 24, from MacLeod (1960a); 25, from Killington (1946); 26, from Morton (1910); 27, from Killington (1932b); 28, from Monserrat (1983a). At different scales.
| |
El tiempo de desarrollo larvario oscila entre uno y dos meses, dependiendo de las condiciones ambientales y del alimento disponible, aunque desarrollos más breves han sido citados (13 días cita Monserrat, 1983a en el de W. navasi, y 10 días hemos observado y ahora citamos en el de Sympherobius fallax). El primer estadio exige tiempos de 2-9 días, el segundo de 1-14 días, y el tercero, generalmente más largo, de 2-19 días (Killington, 1936, 1937; Neuenschwander, 1975; Miller & Cave, 1987; Canard & Volkovich, 2001). Por citar algunos ejemplos Killington (1932b, 1932c, 1936, 1946) anota de 3-18 días para pasar a 2° estadio, 2-14 días para pasar al 3° y 4-19 días para iniciar la pupación en diferentes especies británicas, Monserrat (2003) anota la primera muda a los 4 días y 32-35 días en completar el desarrollo de Hemerobius bolivari, 4 días y 12-14 días para Hemerobius chilensis y Nomerobius cuspidatus, 4-6 días y 24-30 días para Sympherobius gayi, y 3-4 días y 15-16 días para Gayomyia falcata, y Neuenschwander (1975) y New (1984) aportan interesantes datos sobre el desarrollo larvario de especies americanas y tropicales en diferentes condiciones experimentales.
Sobre la morfología de las fases larvarias (Figs. 12, 19-28) conviene mencionar que, a nivel general, son escasamente conocidas, desconociéndose en muchos géneros y en la mayoría/muchas de sus especies (incluso en la fauna europea, Gepp, 1986). Recientemente se han venido describiendo nuevos datos, que poco a poco tratan de completar esta laguna (Essig, 1910; Morton, 1910; Moznette, 1915a, 1915b; Cutright, 1923; Smith, 1923; Withycombe, 1925; Kimmins, 1931, 1939a; Bodenheimer, 1930; Killington, 1932b, 1932c, 1932g, 1934b, 1936, 1937, 1946; Morton, 1935; Fraser, 1940; Fulmek, 1941; Nakahara, 1955; Kawashima, 1958; MacLeod, 1960a; Bänsch, 1964; Peterson, 1967; New, 1967a, 1968a, 1975c; Agekyan, 1973; Neuenschwander, 1975; Yang, 1980b; Samson & Blood, 1979; Miller & Lambdin, 1982, 1984; New & Boros, 1983; Monserrat, 1983a, 2003, 2008a, 2008b; Babrikova, 1984; Gepp, 1984, 1986, 1990; Hussein, 1984, 1985; Paulus, 1986; Miller & Cave, 1987; Veenstra et al., 1990; Gepp, 1990; Krakauer & Tauber, 1996; Souza, 1997; Dey & Bhattacharya, 1997; Tauber & Krakauer, 1997; Monserrat et al., 2001; Oswald & Tauber, 2001; Reguilón, 2002; Reguilón & Nuñez Campero, 2005, etc.).
Sobre las fases larvarias de esta familia conviene recordar que, en muchos casos, son de difícil cría en laboratorio, bien porque difícilmente se induce a la ovoposición en los imagos, o bien porque los huevos no prosperan y mueren antes de eclosionar (Gepp, 1986), amén de la citada y curiosa especificidad que poseen muchas especies en el tipo de superficie que eligen para efectuar las puestas (De Montmollin, 1978), de la alta mortalidad en condiciones experimentales (Dunn, 1954 anota hasta el 50%), o en la especificidad en el tipo de presas requeridas en ciertos casos, por lo que no es un tema fácil.
Sobre la identificación de las fases larvarias, y para el lector interesado, aportamos una sencilla clave general de las larvas ibéricas a nivel de género, y recomendamos a Veenstra et al. (1990), quienes aportan una clave de los géneros europeos y Gepp (1984) y Oswald & Tauber (2001), quienes recopilan los datos existentes sobre la descripción de los estadios preimaginales, bien europeas o bien de las especies entonces conocidas, incluidas muchas de las especies ibéricas (más información sobre la morfología de las fases preimaginales puede recabarse en la citada bibliografía adjunta, y de las especies presentes en la Península Ibérica/Baleares se anota, en cada una de ellas, las referencias existentes).
La pupación se realiza mediante la fabricación de un capullo de seda segregado por los tubos de Malpighi y que sale por el ano, utilizando eficazmente los ágiles últimos segmentos abdominales para su ejecución y tejido (Carpenter, 1940). Suele estar formado por una doble capa, una primera y más externa, tenue y laxa, que fijará el todo al medio elegido, y una posterior, más compacta e interna (propiamente capullo) que es ovoide, de extremos redondeados y de dimensiones variables según el tamaño de las larvas (Canard & Volkovich, 2001). Suelen elegir zonas protegidas para efectuar la construcción del capullo, hojas secas, entre la base de las acículas, bajo cortezas, entre fisuras, en pies de árboles, a veces en el interior de piñas o de agallas, nidos de pájaros e incluso exuvias pupales de otros insectos (Smith, 1923; Killington, 1936; Tjeder, 1961; Deyrup & Deyrup, 1978; Monserrat, 1986a; Miller & Cave, 1987; Gepp, 1999, etc.). Según la época del año y especies, la fase de prepupa (Fig. 29), ya incapaz de desplazarse y fuertemente recurvada sobre sí misma en sus extremos dentro del capullo, puede durar 4-5 días desde que se tejió el capullo, antes de pasar a la fase de pupa (Fig. 30), o mantenerse en este estadio para pasar el invierno (Carpenter, 1940).
La pupa (Fig. 30) es de tipo dectica y exarata, con mandíbulas simétricas portadoras de un diente interno y otro apical, y como las antenas, son libres, hecho habitual en los Neuropterida. El periodo pupal es relativamente corto, y la emergencia del imago, generalmente al atardecer.
Si no se utiliza esta fase para hibernar, emerge posteriormente el imago en 5-7, 9-14, 10-40, 28-41 días según los datos publicados (9-10 días hemos observado y ahora citamos en Sympherobius fallax), tras liberarse del capullo de seda que corta con sus mandíbulas, como ahora citaremos. De forma similar a lo que acontece en Mantispidae, Berothidae, Sisyridae u Osmylidae, la salida del capullo se ve favorecida por la posesión de dos pares de dentículos curvos y opuestos sobre la región tergal de los segmentos 3° y 4° del abdomen pupal (Fig. 30) que actúan como anclaje para liberarse de la exuvia pupal (Morton, 1910; Standfuss, 1910; Killington, 1934b, 1936, 1946). Para zafarse del capullo de seda que la pupa corta con sus mandíbulas, deja abandonada en ella su exuvia pupal, y tras liberarse de ella, queda libre el imago, que suele trepar por una superficie vertical para favorecer la expansión y endurecimiento de sus alas. Tras este crítico y vulnerable periodo (Canard & Volkovich, 2001), y tras expeler el meconio (restos del contenido acumulado en el tubo digestivo que no ha podido ser eliminado por el ano con anterioridad, debido a la falta de conexión entre el mesodeo y proctoeo, elemento que caracteriza a todos los estados juveniles de los neurópteros), en una hora está listo para volar. Tras un periodo de maduración de las gónadas (3-10 días), en el que este tipo de insectos suelen dispersarse (Laffranque & Canard, 1975; Duelli, 1984; New, 1984; Souza, 1988; Canard & Volkovich, 2001), están listas para el cortejo y la reproducción. El proceso de emergencia del imago es detalladamente descrito por Killington (1936), y lógicamente los tiempos citados como empleados en las diferentes fases de desarrollo son algo variables según las especies y las observaciones efectuadas por los diferentes autores, y se han citado entre 17-27 días a 7-8 semanas entre la salida de la larva del huevo y la emergencia del imago (Smith, 1923; Dunn, 1954; Canard & Volkovich, 2001).
Mayoritariamente en nuestras latitudes las poblaciones se desarrollan durante los meses de primavera y verano, normalmente sucediéndose varias generaciones en función de la temperatura, humedad, fotoperiodo, etc., y de los recursos del medio, y la hibernación suele producirse en fase de prepupa, más raramente en pupa, y ocasionalmente en cualquier fase desde huevo a imago, aunque larvas de varios géneros mantienen su actividad a bajas temperaturas (Hemerobius, Wesmaelius, Micromus), aunque lógicamente las elevadas altitudes y latitudes limitan sus poblaciones (Morton, 1910; Withycombe, 1925; Killington, 1929, 1936, 1937; Carpenter, 1940; Rivnay, 1943; Zelený, 1963, 1984; Laffranque & Canard, 1975; Neuenschwander, 1975; Greve, 1978; Samson & Blood, 1979; Neuenschwander & Hagen, 1980; Syrett & Penman, 1981; Kevan & Klimaszewski, 1987; New, 1989; Luquet, 1991; Collins, 1996; Canard, 1997; Szentkirályi, 2001a; Horton et al., 2002; Monserrat, 2004; Penny et al., 2007; Yadav et al., 2008; Ocharan & Ocharan, 2011). En zonas de la península litorales y más meridionales (probablemente también en Baleares) las poblaciones se desarrollan y suceden a lo largo de todo el año, incluso en los meses de invierno, e incluso alguna especie, quizás para evitar la competencia con otras especies o para sortear los meses más calurosos, parece tener mayor actividad durante estos meses de invierno (ver fenologías de las especies en cada caso). También en nuestras latitudes, otras especies como H. stigma poseen también actividad ya pasado el otoño, incluso invierno, y en zonas costeras más meridionales ésta y otras especies tienen actividad a lo largo de todo el año. La mayoría de las especies parecen tener ciclos bivoltinos, aunque en ciertas condiciones especies como P. diptera o M. variegatus, parecen poseer ciclos monovoltinos (Killington, 1936, 1937; Szentkirályi, 1992, 1997), y también ciclos monovoltinos están citados en especies adaptadas a medios, latitudes o altitudes más rigurosos (Micromus angulatus, Wesmaelius concinnus, W. balticus, W. quadrifasciatus, W. malladai, W. mortoni, W. nervosus y probablemente W. ravus y W. fassnidgei, Hemerobius pini, etc.), aunque en algunos casos esto puede variar y adaptarse a la latitud y la altitud de las poblaciones, o los imagos entran en diapausa invernal. En nuestras latitudes se han citado hasta 5-8 generaciones anuales (Rivnay, 1943; Hinke, 1975; Miermont & Canard, 1975), y en zonas tropicales y/o subtropicales las generaciones se suceden sin ninguna diapausa (New, 1984, 1986, 1988c), y curiosamente, sólo W. navasi parece tener diapausa estival, hecho conocido de otras familias próximas, como Chrysopidae (Canard & Volkovich, 2001), pero este hecho no había sido citado en esta familia (New, 1986) y, en cualquier caso, la relativamente larga longevidad de las hembras (hasta 35 meses) y de su prolongado periodo reproductor hace dificultoso calibrar el número de generaciones reales en las poblaciones de la mayoría de nuestras especies, dado que se solapan las poblaciones derivadas del periodo reproductor de una misma hembra (New, 1986; Canard & Volkovich, 2001). Killington (1936: 148-149) anota las fenologías de las especies del Reino Unido.
Por último, diversos tipos de parásitos han sido citados en esta familia, bien sobre sus larvas o emergiendo de sus capullos, especialmente himenópteros parasitoides (Chalcidoidea, Ichneumonoidea, Cynipoidea: Figitidae, Anacharitidae, Pteromalidae) (Xyalaspis, Anacharis, Aegilips, Hemiteles, Telenomus, Gelis, Homocidus, Dibrachys), alcanzando en ocasiones porcentajes superiores al 50% (Howard, 1891; Miles, 1924; New, 1967b, 1975b, 1984; Lipkow, 1969; Aspöck et al., 1980; Pantaleoni, 1984; Miller & Lambdin, 1985; Cave & Miller, 1987). También ácaros, taquínidos, hongos, gregarinas y nematomorfos se han citado como parásitos de larvas, pupas e imagos (Geus, 1969; Manuel, 1981; Monserrat, 1984b; Devetak, 2014), alcanzando en ocasiones hasta un 86.7% de insectos infectados. Killington (1932d, 1932f, 1934a) anota interesantes datos al respecto, y Killington (1936: 176-179) ofrece una detallada información de parásitos en sus diferentes fases. Tentativamente Forsius (1924) ha citado Forcipomyia (Diptera: Ceratopogonidae) como ectoparásito de alguna especie de Hemerobius (frecuentemente citados como ectoparásitos de Neuroptera, especialmente Chrysopidae). Obviamente también son presas de artrópodos predadores, principalmente arañas, larvas de coccinélidos y sírfidos, hormigas, odonatos, asílidos, etc., así como de anfibios, aves y murciélagos (Needham, 1905; Killington, 1932a, 1932e, 1932h, 1936; New, 1975b; Daane, 2001; Szentkirályi & Kristín, 2002).
Breve historial sobre su taxonomía y su conocimiento en la Península Ibérica y Baleares
El concepto de los “actuales” hemeróbidos incluía en los inicios a prácticamente todas las familias que hoy día constituyen el Orden Neuroptera, que por otra parte, y desde el concepto Linneano, se ha ido desglosando en diferentes órdenes actualmente reconocidos (Krüger, 1915; Tjeder, 1952; New, 1989; Pantaleoni, 2010). Tras las primeras descripciones (Linnaeus, 1758, 1761, 1767; Geoffroy, 1762; Fabricius, 1777, 1781, 1793; Schrank, 1781; De Geer, 1783; Latreille, 1796, 1802, 1804, 1825, 1831; Cuvier, 1817; Stephens, 1836; Burmeister, 1839; Schneider, 1845, 1851; Hagen, 1850, 1851, 1854, 1866a, 1866b; Brauer, 1852; Walker, 1853; Brauer & Löw, 1857; Costa, 1863; Wallengren, 1863, etc.), es Rambur (1842) el que cita por primera vez un hemeróbido en la Península Ibérica, apareciendo con el tiempo algunos trabajos posteriores con citas o referencias sobre la fauna Ibérica (Walker, 1853; Costa, 1855; Rosenhauer, 1856; Pictet, 1865; Hagen, 1866c; Bolívar, 1878; McLachlan, 1880, 1899, 1902a, 1902b, 1903; Cuní y Martorell, 1880, 1888, 1890; Lucas, 1905, 1906; Morton, 1912, etc.), y a su vez los primeros intentos en organizar su taxonomía y su sistemática conforme se desglosaban algunos taxa en familias distintas y aún algunas (Osmylidae, Sisyridae, Nevrorthidae) tardarían en constituirse, y poco a poco la familia Hemerobiidae iba adquiriendo entidad (Rambur, 1842; Brauer, 1852, 1855, 1866, 1868, 1876; Curtis, 1854, 1862; Brauer & Löw, 1857; Hagen, 1861; McLachlan, 1863, 1867, 1868, 1869, 1899; Wallengren, 1871; Perkins, 1899, 1910; Handlirsh, 1906-1908, etc.), siendo Tillyard (1916) quien la dejó definida.
Poco a poco van realizandose obras, monografías y revisiones que afectan a diferentes faunas, destacando Hagen (1858, 1859, 1861, 1862, 1888); Albarda (1889); Currie (1904a, 1904b); Needham (1905, 1909); Banks (1905, 1909, 1910, 1913a, 1913b, 1918, 1920, 1932, 1937a, 1937b, 1940); Mjöberg (1909); Péringuey (1910, 1911); Weele (1910); Nakahara (1915a, 1915b, 1915c, 1919, 1954, 1956, 1960a, 1960b, 1960c, 1964, 1966a, 1966b, 1966c, 1971); Esben-Petersen (1914, 1920a, 1920b, 1921, 1924, 1928a, 1928b, 1931, 1935, 1936, 1937); Tillyard (1917, 1923, 1926a, 1926b); Comstock (1918); Withycombe (1922a, 1923, 1925); Krüger (1922, 1923); Lackschewitz (1922, 1929); Smith (1923, 1931); Kuwayama (1924, 1956, 1962, 1964); Lestage (1925, 1928, 1929); Williams (1927); Killington (1929, 1933, 1934c, 1935, 1936, 1937); Tjeder (1930, 1931, 1932, 1936a, 1939); Kimmins (1928, 1929a, 1929b, 1932, 1933, 1935a, 1935b, 1936, 1937, 1938, 1939b, 1940, 1943, 1956, 1958, 1959, 1960, 1963); Morton (1931, 1935); Carpenter (1940, 1961); Zimmerman (1940, 1946, 1957); Fraser (1942, 1951, 1955, 1957); Gurney (1948); Wegenek (1950); Handschin (1955); Auber (1956); Parfin (1956), Kozhanchikov (1956); Tjeder (1941, 1948, 1952, 1955, 1957, 1961, 1963a, 1963b, 1968, 1975); MacLeod (1960a, 1963, 1964); Nakahara (1960c); Nakahara & Kuwayama (1961); Kimmins (1960); Zelený (1962a, 1962b, 1963, 1964, 1971); Aspöck (1963); Hölzel (1963, 1964); Yang (1964); Kis (1965, 1968); Steinmann (1965a, 1965b, 1968, 1971); Aspöck & Aspöck (1965, 1966); Ohm (1967); Stange (1967), Alayo (1968), etc., existiendo además multitud de artículos relacionados con la Entomología Aplicada y/o con las faunas locales, que escapan a la intención de esta contribución.
Como está ocurriendo en la Zoología y la Entomología en general, con las nuevas herramientas moleculares han venido apareciendo artículos que pueden modificar la situación de numerosas especies y la posición de muchos taxa se va a ver, sin duda, afectada en un futuro (Morinière et al., 2014).
La lista de las especies, subespecies, variedades y formas actuales del mundo, sus sinonimias, especies tipo de cada género, nomina dubia y nomina nuda es aportada por Monserrat (1990c), quien recoge entonces la existencia de 546 especies válidas pertenecientes a 42 géneros válidos (descontadas las 222 especies y 61 géneros previamente sinonimizados).
A nivel genérico, su taxonomía y sistemática ha sido recientemente tratada (Oswald, 1993a). Sin embargo, su estado general de conocimiento es aún muy incompleto, siendo francamente escasos los trabajos de revisión global en la mayoría de sus géneros, son muchas las especies inadecuadamente descritas y tipificadas, otras no han sido citadas posteriormente desde su descripción original, y otras son muy parcialmente conocidas, siendo muy parco el conocimiento sobre su morfología, venación, genitalia y variabilidad en muchas especies, hecho que conlleva, a veces, a errores de identificación y que provoca confusiones en su distribución geográfica real. Por ello, de forma global, puede decirse que la situación taxonómica y sistemática de las especies de esta familia es aún bastante incompleta y fragmentaria (Kevan & Klimaszewski, 1986, 1987; Klimaszewski & Kevan, 1987a, 1987b, 1988a, 1988b, 1990a, 1990b, 1990c).
Sin duda, las faunas Paleártica, Neártica y Australiana son las mejor conocidas sobre este particular, si bien el límite real de distribución de muchas especies es, con frecuencia, impreciso o incompleto y, en ocasiones, los datos sobre su biología son escasos y el nivel de conocimiento de las faunas de muchos países, incluso en zonas relativamente bien estudiadas como Europa y Estados Unidos es aún poco satisfactorio. Este hecho es aún más evidente en faunas de otros continentes, y nuevas obras han sido afrontadas, y desde el último tercio del pasado siglo al presente nuevos trabajos van aportando nuevos datos que van completando las lagunas existentes sobre su taxonomía, distribución, faunística, biología y catalogación (Hölzel, 1970, 1973, 1988, 1995, 2002; Yaseen & Krishnaswamy, 1972; Zelený, 1972, 1976; Ghosh, 1976, 1977, 1990; Penny, 1977; Barnard, 1978, 1990; Aspöck et al., 1980; Yang, 1980a, 1980b, 1981a, 1981b, 1988, 1997, 1999; Monserrat, 1980c, 1983a, 1984c, 1984f, 1985a, 1986a, 1989, 1990 a, 1990b, 1990c, 1990d, 1991a, 1992 a, 1992b, 1993, 1994, 1996a, 1997, 1998, 2000, 2001, 2002, 2003, 2004, 2008a, 2011; González Olazo, 1981, 1987a, 1987b, 1992a, 1992b, 1992c, 1993; MacLeod & Stange, 1981, 2001; New, 1981; Leraut, 1982, 1989, 1991a, 1991b; Monserrat & Penny, 1983; Penny & Monserrat, 1983; Penny & Sturm, 1984; Makarkin, 1984, 1985, 1986, 1990, 1991b, 1993, 1994, 1995, 1996a, 1996b; Klimaszewski & Kevan, 1985, 1987a, 1987b, 1988a, 1988b, 1990a, 1990b, 1990c, 1992; Oswald, 1985, 1987, 1988a, 1988b, 1990, 1991, 1993a, 1993b, 1994, 1996, 2004; Popov, 1986a, 1986b, 1996, 2002a, 2002b; Kevan & Klimaszewski, 1986, 1987; Monserrat & Hölzel, 1987; Klimaszewski et al., 1987; New, 1988a, 1988b, 1989; Oswald & Penny, 1991; Baert et al., 1992; Henry et al., 1992; Dobosz, 1993; Poggi, 1993; Wise, 1993, 2000; Marín & Monserrat, 1995a, 1995b; Aspöck & Hölzel, 1996; Monserrat & Marín, 1996a; Penny & Lee, 1996; Penny et al., 1997, 2007; Monserrat & Deretsky, 1999; Pantaleoni, 1999; Aspöck et al., 2001; Monserrat et al., 2001; Lara & Freitas, 2002, 2003; Oswald et al., 2002; New, 2003; Reguilón & Nuñez Campero, 2005; Hölzel, 2007; Makarkin & Monserrat, 2007; Kim & Cho, 2011; Monserrat et al., 2013b, etc.). Para los interesados en conocer información sobre la bibliografía de esta familia se recomienda Oswald (2013b).
No sería posible concebir el estudio de los neurópteros en general, y de los hemeróbidos (incluidos los de Andorra, España y Portugal) en particular, sin las numerosas publicaciones del autor español Longinos Navás (1858-1938), prolífico, heterogéneo y controvertido autor en numerosos campos, quien durante casi cuarenta años centró la mayoría de sus estudios en la taxonomía y sistemática de este grupo de insectos, y que en el caso de la familia que nos ocupa y por su extensión, no hemos pormenorizado en la relación de autores y obras anteriormente citada. En ellas se describen numerosos nuevos taxa (Monserrat, 1990c) y se incluyen multitud de citas de hemeróbidos en nuestra fauna. Lamentablemente los criterios taxonómicos seguidos por él han resultado ser de escaso valor y rigor científico, y sus identificaciones y descripciones de nuevos taxa han sido frecuentemente puestas en duda, ya que mayoritariamente en sus identificaciones no tenían en cuenta la genitalia, y basaba sus estudios casi exclusivamente en caracteres como la venación o coloración alar (en gran parte muy variables), y por ello sus trabajos consisten en un compendio de taxa nuevos, que más que un avance, aportaron mucha confusión, y por ello su obra ha sido permanentemente motivo de controversia. Como ejemplos de su confusa labor relacionada con la familia que tratamos, citemos que Monserrat (1986c, 1990c) recoge, nada menos que, 28 géneros, 159 especies y 3 variedades de hemeróbidos descritos por este autor a lo largo de su vida, y como ejemplos de su hacer, citemos que Monserrat (1990d) revisa las 28 especies descritas por este autor pertenecientes al género Micromus, y solo 7 permanecieron como válidas, Monserrat (2011) propone como sinonimias de especies previamente por él descritas o confirma las sinonimias de cuatro de sus especies de nuestra fauna, y Monserrat (1986a, 1986b, 1991b) detecta numerosos errores de identificación que hacen frecuentemente dudosos sus datos faunísticos. Piénsese que sólo de estos tres órdenes de insectos (Neuropterida) describió aproximadamente 375 géneros, 2.173 especies y 301 variedades (Monserrat, 1986c), es decir 2.849 taxa, del total de 388 géneros y 2.684 especies por él descritos de diferentes órdenes de insectos y arácnidos (Monserrat, 1985a, 1986c, 2011; Bastero Monserrat, 1989), y en lo que a nuestra fauna incumbe, de todos estos taxa, multitud de géneros, y nada menos que 152 especies y 149 variedades de Neuropterida fueron descritas por él en la Fauna Ibero-Balear, que sumadas a las descritas de las Islas Canarias (Ohm & Báez, 2004; Báez & Oromí, 2010) alcanzan un total de 239 taxa: 4 de Megaloptera y 208 de Neuroptera (+15 de Canarias), y en la familia que nos compete, de las 23 especies (+2 variedades) de hemeróbidos descritas por Navás de la fauna iberobalear, solo 3 han resultado válidas (Monserrat, 2011; Monserrat & Triviño, 2013). Por tanto, el gran legado de Navás ha quedado reducido realmente a alguna especie descrita que ha mantenido por prioridad su validez taxonómica (ver listado de especies consideradas y sus sinonimias) y a ciertos datos sobre la potencial distribución geográfica de algunas especies. Desafortunadamente casi son solo sus publicaciones las que nos quedan, ya que su colección privada sufrió diversas y penosas vicisitudes a lo largo de los años (Monserrat, 1985a, 1986c), y por tanto, los ejemplares con los que contamos actualmente depositados en instituciones para revisar su labor son proporcionalmente escasos.
Al margen de estos datos históricos, en lo que respecta a la Fauna Ibero-Balear, se ha venido aportando recientemente abundante información sobre esta familia, aunque aún existen multitud de lagunas y de áreas completamente inexploradas sobre este grupo, especialmente en Portugal y Baleares (Monserrat & Triviño, 2013). Hace algunas décadas Aspöck et al. (1980) revisan las especies europeas y más tarde Monserrat (1986a) ofrece la primera sinopsis reciente de esta familia en nuestra fauna, a la que siguieron otras obras (Monserrat, 1990b, 1991a, 1991b, 1994), y en conjunto, a las especies de esta familia más comunes y habituales que históricamente fueron descritas o iban siendo conocidas en la Península Ibérica se han venido añadiendo más recientemente nuevas opiniones y nuevos elementos (Wesmaelius reisseri, W. helveticus, W. ravus, W. fassnidgei, Sympherobius klapaleki, S. maculipennis, S. gayi, Psectra diptera, Drepanepteryx phalaenoides, Hemerobius perelegans, etc.), con incluso algunas especies neotropicales consideradas/bles como especies invasoras o potencialmente invasoras (Sympherobius gayi, Hemerobius bolivari), que han sido recientemente citadas en la fauna ibérica y alguna aparentemente asentada en Portugal (Monserrat, 1976a, 1976b, 1978a, 1978b, 1984a, 1985c, 1986a, 1990b, 1991a, 1991b, 1993, 1994, 2003, 2004, 2005, 2008a, 2010; Aspöck et al., 1980; Aspöck & Aspöck, 1982; Monserrat & Deretsky, 1999; Tröger, 2007; Monserrat et al., 2013b; Garcia et al., 2013). Todas estas citas han acabado por conformar una de las familias más rica en especies (40) dentro de la Fauna Europea (53) (Aspöck et al., 1980; Monserrat & Triviño, 2013), de las que Letardi et al. (2013) listan 15 especies de la fauna portuguesa continental. Con respecto a la fauna de las Islas Baleares, Monserrat (2005) anota 15 especies, y pone en duda algunas citas antiguas. No ha podido dilucidarse, aun solicitándolo a su autor, la cita de Hemerobius sp. en Menorca que menciona Compte (1968), dato ya comentado por Monserrat (2005).
Recientemente Monserrat (2011) ha resuelto la posición taxonómica de las especies ibéricas pertenecientes a esta familia que, hasta entonces, poseían una situación taxonómica dudosa o sin resolver, y Monserrat & Triviño (2013) aportan la lista de las especies ibero-baleares de esta familia con sus sinonimias y diferentes combinaciones nomenclaturales bajo las cuales han sido citadas en la bibliografía, y en base a las citas fiables existentes y a material inédito, aportan un cartografiado de la distribución de las especies ibéricas, poniendo en evidencia, como hemos indicado, que existen enormes áreas aún no prospectadas, y es de esperar que nuevas sorpresas nos depare el futuro. Por último Monserrat et al. (2013) aportan numerosas de estas citas inéditas e incrementan el número de especies conocidas en las faunas ibérica y europea. Obviamente al tratarse de un grupo con interés en la Entomología Aplicada, existen multitud de artículos en los que se cita la presencia de la familia Hemerobiidae en diversos estudios aplicados realizados en el solar ibérico (Ejs.: Campos & Ramos, 1983; Ruiz Torres & Montiel Bueno, 2001, 2002) que escapan a la intención de esta contribución.
Los neurópteros, y con ellos los hemeróbidos, son excelentes bio-indicadores de la calidad y grado de conservación del Medio Ambiente (New, 1998; Gepp, 1999), y quizás conviene mencionar un pequeño apunte sobre nuestra experiencia en la recolecta de hemeróbidos en la Península Ibérica durante las últimas cuatro décadas, en las que, como hemos observado en otros grupos de neurópteros, hemos detectado una franca regresión en sus poblaciones ibéricas, con una progresiva disminución de sus efectivos dentro de numerosas poblaciones respecto a lo que, no hace demasiado tiempo, antes obteníamos, incluso potenciando más recientemente las unidades de esfuerzo, intensidad y número de investigadores para recolectarlos, y son un ejemplo más del silencioso e imparable deterioro sobre la Naturaleza que las acciones del hombre están provocando sin que apenas sea perceptible, salvo que la edad de algunos entomólogos (como es nuestro caso) lo aprecie y mencione. Esto ya se ha manifestado en otras zonas, algunas muy distantes (y así lo comenta Zimmerman, 1957 en los hemeróbidos de Hawái), hasta el punto de que algunas especies forman parte de la lista de especies amenazadas o en peligro de extinción (Gepp, 1981, 1983, 1999; Tröger, 1993; Röhricht & Tröger, 1998; Pröse & Gruppe, 2003; Röhricht, 2004).
Como no podía ser de otra forma, también los hemeróbidos son actualmente objeto de atención en Internet (McEwen & Oswald, 1998; Röhricht, 2002), y especialmente lo son en multitud de foros que recientemente han aparecido, y por la misma razón aducida para las citas bibliográficas de nuestras especies, estos registros podrían considerarse (siempre que los datos aportados en estas webs sean los correctos), y así lo hemos en tenido en cuenta en algunos casos al anotar parte del nuevo material ahora citado.
A pesar de toda la información publicada hasta la fecha, y en lo que respecta a la Fauna Ibero-Balear, la familia Hemerobiidae no ha sido objeto de una investigación profunda basada en todo el estudio del material del que disponemos en la actualidad. Por otra parte, toda la información existente sobre este orden de insectos en la Península Ibérica y Baleares está muy dispersa o aún es desconocida, y consideramos que es de gran importancia subsanar dicha laguna efectuando una revisión completa, que es lo que pretendemos en la presente contribución.
En ella se realiza una revisión de la familia Hemerobiidae de la Península Ibérica e Islas Baleares, que incluye la recopilación de toda la información bibliográfica general existente relacionada con esta familia (761 referencias bibliográficas anotadas), y con nuestras especies, sobre sus sinonimias comúnmente aceptadas y sobre las diferentes combinaciones nomenclaturiales bajo las cuales han sido citadas en la bibliografía (siempre nos quedará alguna en el “tintero”), aportando el listado actualizado de las especies conocidas en la zona, así como una clave de identificación de sus géneros (imagos y larvas) y de sus especies, y de cada una de ellas, anotamos, cuando sea preciso, datos sobre su taxonomía, morfología y/o variabilidad, y los datos conocidos sobre sus estadios juveniles, cuando existan, así como toda la información existente sobre su biología, distribución geográfica, fenológica y altitudinal, tanto en general, como referente a los datos conocidos en nuestra fauna. Se concluye con un breve listado de especies dudosa- o incorrectamente citadas en nuestra fauna.
Material y MétodoTOP
Para la realización de esta revisión, y partiendo de la información general conocida (en su conjunto 761 referencias bibliográficas que citamos), recopilamos y ordenamos de toda la información existente en la bibliografía referente a los hemeróbidos ibérico-baleares (74 referencias bibliográficas), datos que se exponen en cada una de las especies tratadas, recopilando, cronológicamente ordenadas, todas las referencias bibliográficas existentes, a partir de las cuales recabamos toda la información existente sobre cada una de ellas en nuestra fauna. Anotamos los autores de estas citas, su fecha de publicación y la/s página/s donde se aporta información sobre su biología (bio), descripción original (d), distribución geográfica (dis), morfología del huevo (h), inclusión en claves (key), larva (l), aparezca en un listado (list), morfología del imago (mf), pupa (p), simple referencia a alguno de los paises de la Península Ibérica, o nota sobre la especie (rf), o su taxonomía (tx). Se obvian las reseñas a la lista de especies actuales del mundo aportada por Monserrat (1990c), ya que en ella se anota para cada especie el país a partir del cual se describió la especie y son numerosas las especies ibéricas originariamente descritas de muchos otros países, o en nuestro caso, fuera del ámbito preninsular-balear.
En principio, y por las diferencias morfológicas existentes en alguna de las diferentes especies que tratamos, cabría suponer que las identificaciones dadas por los autores pretéritos son acertadas, sin embargo esta recopilación adjuntada es meramente informativa, y no siempre implica la total asunción de sus contenidos, de hecho hacemos varias referencias a identificaciones y citas cuestionables, y anotamos un apartado final con citas erróneas o dudosas. Por todo ello, para evitar la utilización de datos poco fiables citados en la bibliografía y correr el riesgo de asumir como ciertos datos basados en identificaciones erróneas o incorrectas, mezclando información de unas y otras especies, y habida cuenta del abundante material que hemos estudiado (5338 ejemplares), para la realización del estudio comparativo sobre la biología, fenología y distribución altitudinal y fenológica de las especies ibéricas, sólo se ha tenido en cuenta el material revisado y estudiado por nosotros, sea el material que hemos estudiado perteneciente a diferentes colecciones e instituciones o sea el material recolectado por nosotros en los cuarenta últimos años en diferentes puntos de la Península Ibérica y Baleares, y que en ambos casos ya ha sido publicado (4931 ejemplares), o sea el nuevo material inédito, por nosotros recolectado o estudiado, y que ahora anotamos (341 ejemplares). También puntualmente se ha tenido en cuenta algún dato aportado por autores recientes de reconocida solvencia (66 ejemplares).
Salvo algunos ejemplares pertenecientes al Instituto Andaluz de Investigación y Formación Agraria, Laboratorio de Entomología Agraria, Málaga, España (IFAPA), el resto del material, citado permanece en la colección de V. J. Monserrat (depositada en la Universidad Complutense de Madrid, España).
El material estudiado se cita ordenado alfabética- y cronológicamente, indicándose en función de los datos de captura disponibles y por este orden: país, provincia/isla, localidad de captura, coordenadas, altitud en msnm (consideramos 10 m como dato a nivel del mar), fecha de captura, número de ♂♂, de ♀♀ y/o de larvas estudiados, planta, substrato o medio sobre el que han sido recolectados (por economía de espacio, los géneros de las plantas sobre las que se han hallado los ejemplares se citan apocopados, una vez han sido citados dentro de cada una de las especies mencionadas), recolector (por igual motivo, sólo se anota su recolector si no ha sido el autor de esta contribución) y, en su caso, institución a la que dicho material pertenece, según las siglas anteriormente anotadas. Cuando hemos estimado oportuno, también se anota, como material complementario de comparación, otro material no ibérico-balear.
Para todas las especies se comentan los datos más generales sobre cada una de ellas y, cuando lo hemos considerado necesario, los más destacables sobre su morfología externa y/o variabilidad, y de todas ellas ilustramos sus segmentos genitales, y aportamos los datos conocidos y los ahora aportados sobre su biología, fases juveniles (en su caso conocidas) y su distribución fenológica, altitudinal, y geográfica en la zona, así como, en algún caso, un apartado de discusión, donde se anotan los datos que hemos considerado necesario comentar. Para las fenologías de cada especie, no han sido considerados los ejemplares obtenidos ex ovo y cultivados artificialmente en condiciones no naturales.
Aunque existen datos en la morfología externa que ayudan a la identificación de las especies ibérico-baleares de esta familia, y así los utilizamos en las claves, el estudio de la genitalia es necesario para la segura y correcta identificación, especialmente en todas las especies de algunos géneros y en ejemplares inmaduros o escasamente pigmentados de algunas especies. Para ello se procedió a la separación de los últimos cuatro segmentos del abdomen mediante disección. Si el material estaba conservado en seco se ha hidratado previamente durante 24 horas por inmersión en agua, y posteriormente se han aclarado estos últimos segmentos con hidróxido potásico al 10% templado para acceder a las estructuras genitales. Una vez realizado este proceso hemos introducido la genitalia en glicerina dentro de un portaobjetos excavado para su observación mediante un estereo-microscopio ZEISS® STEMI-SV8 con cámara clara de dibujo incorporada. En la genitalia anotada para cada especie, solamente indicamos los elementos que son habitualmente utilizados para la identificación específica.
Las fotografías de realizaron por los autores que se indican, y en las páginas web anotadas puede recabarse información complementaria. Los dibujos se realizaron a mano alzada con cámara clara y, tras pasarse a tinta china sobre papel vegetal, se retocaron utilizando el programa de diseño Corel Paint Shop Pro Photo XI.
Para la ordenación sistemática se sigue a Oswald (1993a). Para la distribución general de las especies se ha seguido a Aspöck et al. (1980) y H. Aspöck et al. (2001), y sobre la preferencia de sustrato vegetal de las especies citadas puede consultarse Monserrat & Marín (1996a, 1996b).
ResultadosTOP
Los hemeróbidos de la Península ibérica y Baleares. Listado de subfamilias, géneros, subgéneros y especies
Hemerobiidae Latreille, 1802
Hemerobiinae Latreille, 1802
Hemerobius Linnaeus, 1758
Especie tipo: Hemerobius humulinus Linnaeus, 1758
Hemerobius (Hemerobius) bolivari Banks, 1910
Hemerobius (Hemerobius) contumax Tjeder, 1932
Hemerobius (Hemerobius) gilvus Stein, 1863
Hemerobius (Hemerobius) handschini Tjeder, 1957
Hemerobius (Hemerobius) humulinus Linnaeus, 1758
Hemerobius (Hemerobius) lutescens Fabricius, 1793
Hemerobius (Hemerobius) micans Olivier, 1792
Hemerobius (Hemerobius) nitidulus Fabricius, 1777
Hemerobius (Hemerobius) perelegans Stephens, 1836
Hemerobius (Hemerobius) pini Stephens, 1836
Hemerobius (Hemerobius) simulans Walker, 1853
Hemerobius (Hemerobius) stigma Stephens, 1836
Wesmaelius Krüger, 1922
Especie tipo: Hemerobius concinnus Stephens, 1836
Subgénero Kimminsia Killington, 1937
Especie tipo: Hemerobius betulinus Strøm, 1788
Wesmaelius (Kimminsia) fassnidgei (Killington, 1933)
Wesmaelius (Kimminsia) helveticus (Aspöck & Aspöck, 1964)
Wesmaelius (Kimminsia) malladai (Navás, 1925)
Wesmaelius (Kimminsia) navasi (Andréu, 1911)
Wesmaelius (Kimminsia) nervosus (Fabricius, 1793)
Wesmaelius (Kimminsia) ravus (Withycombe, 1923)
Wesmaelius (Kimminsia) reisseri Aspöck & Aspöck, 1982
Wesmaelius (Kimminsia) subnebulosus (Stephens, 1836)
Subgénero Wesmaelius Krüger, 1922
Especie tipo: Hemerobius concinnus Stephens, 1836
Wesmaelius (Wesmaelius) concinnus (Stephens, 1836)
Wesmaelius (Wesmaelius) quadrifasciatus (Reuter, 1894)
Sympherobiinae Comstock, 1918
Sympherobius Banks, 1904
Especie tipo: Hemerobius amiculus Fitch, 1855
Sympherobius elegans (Stephens, 1836)
Sympherobius fallax Navás, 1908
Sympherobius fuscescens (Wallengren, 1863)
Sympherobius gayi Navás, 1910
Sympherobius klapaleki Zelený, 1963
Sympherobius pellucidus (Walker, 1853)
Sympherobius pygmaeus (Rambur, 1842)
Sympherobius riudori Navás, 1915
Microminae Krüger, 1922
Micromus Rambur, 1842
Especie tipo: Hemerobius variegatus Fabricius, 1793
Micromus variegatus (Fabricius, 1793)
Micromus angulatus (Stephens, 1836)
Micromus lanosus (Zelený, 1962)
Micromus paganus (Linnaeus, 1767)
Megalominae, Krüger, 1922
Megalomus Rambur, 1842
Especie tipo: Megalomus tortricoides Rambur, 1842
Megalomus hirtus (Linnaeus, 1761)
Megalomus pyraloides Rambur, 1842
Megalomus tineoides Rambur, 1842
Megalomus tortricoides Rambur, 1842
Drepanepteryginae Krüger, 1922
Drepanepteryx Leach, 1815
Especie tipo: Hemerobius phalaenoides Linnaeus, 1758
Drepanepteryx phalaenoides (Linnaeus, 1758)
Notiobiellinae Nakahara, 1960
Psectra Hagen, 1866
Especie tipo: Hemerobius dipterus Burmeister, 1839
Psectra diptera (Burmeister, 1839)
Clave de géneros, subgéneros y especies de Hemerobiidae de la Península Ibérica e Islas Baleares
Utilizamos caracteres lo más accesibles y sencillos posibles, como es el caso de la morfología y venación alar que sean suficientes para llegar a nivel de género (Figs. 31-39), con el que, en el caso de los géneros monoespecíficos (Drepanepteryx, Psectra) se alcanza el nivel de especie (Figs. 98, 99), por lo que no consideramos necesario incluir sus caracteres de su genitalia. Las figuras anotadas para acceder a los caracteres de venación o pigmentación alar (Figs. 31-39) están idealizadas con el fin de resaltar los caracteres empleados y hacerlos más accesibles al lector. Para los restantes géneros se suman otros elementos complementarios de la pigmentación tegumentaria y alar (Hemerobius, Sympherobius, Micromus) (Figs. 40-54, 88-97), así como de la genitalia (Figs. 55-67, 100-107, 114-117) que es altamente recomendable, si no obligado, y que es imprescindible para los restantes géneros (Wesmaelius, Megalomus) (Figs. 68-87, 110-113). Por ello, en estos géneros aportamos la genitalia para cada especie, y de ella solamente indicamos los elementos más accesibles, y que son los habitualmente utilizados para la identificación específica.
| 1 |
Alas anteriores con vena humeral recurrente (Figs. 14, 32) |
|
2 |
| - |
Alas anteriores sin vena humeral recurrente (Figs. 15, 31) |
|
6 |
| 2 |
Alas anteriores marcadamente falcadas (Figs. 11, 33, 98), con 10 o más ramas del SR, campo costal con numerosas venillas conectadas por una serie de venillas transversales y 3 series de venillas gradadas (Figs. 33, 98) |
|
Drepanepteryx |
| - |
Alas anteriores no falcadas (Figs. 1-10), con menos de 10 ramas del SR, campo costal con venillas no conectadas por varias series de venillas transversales y 1 o 2 series de venillas gradadas (Figs. 34-39) |
|
3 |
| 3 |
Alas anteriores con campo costal ancho y 5 o más ramas del SR (Figs. 3, 5, 34, 108, 109) |
|
Megalomus |
| - |
Alas anteriores con campo costal estrecho y menos de 5 ramas del SR (Figs. 1, 7-10, 35-39) |
|
4 |
| 4 |
En las alas posteriores la Mp se bifurca muy distalmente respecto al origen de la primera rama del SR (Fig. 36) |
|
5 |
| - |
En las alas posteriores la Mp se bifurca al mismo nivel que el origen de la primera rama del SR (Fig. 37) |
|
Wesmaelius |
| 5 |
Alas anteriores con 5 o más gradadas externas y vena basal entre R y M sobre el radio o anterior al origen de la primera rama del SR. Alas posteriores con varias venillas en la serie de gradadas externas (Figs. 14, 36, 40-54) |
|
Hemerobius |
| - |
Alas anteriores con 4 o menos gradadas externas y vena basal entre R y M posterior al origen de la primera rama del SR. Alas posteriores sin, o como máximo con una venilla en la serie de gradadas externas (Figs. 35, 88-97) |
|
Sympherobius |
| 6 |
Alas anteriores con 2 SR. Venillas del campo costal apenas bifurcadas, sin incrementar su número hacia el pterostigma. Campo subcostal con, al menos, 5 venillas transversales. Una serie de venillas gradadas. Alas posteriores a veces reducidas y rudimentarias (Figs. 15, 38, 99) |
|
Psectra |
| - |
Alas anteriores con 3 o más SR. Venillas del campo costal bifurcadas en su mayoría, incrementándose su número hacia el pterostigma. Campo subcostal con 1-3 venillas transversales. Dos series de venillas gradadas (Fig. 39). Alas posteriores nunca reducidas o rudimentarias |
|
Micromus |
|
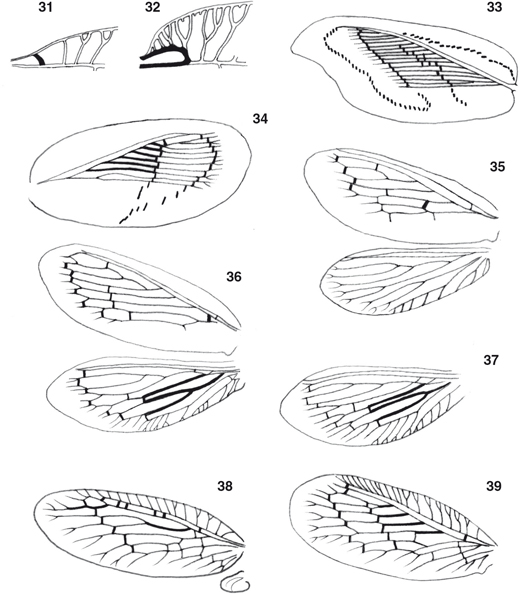 Figs. 31-39.— Esquemas de los caracteres en la venación alar de diferentes géneros de hemeróbidos (para facilitar al lector su interpretación, se potencian los elementos idealizándolos al resaltarlos en negro): 31: base del campo costal de las alas anteriores sin vena humeral recurrente; 32: ídem, con vena humeral recurrente; 33: ala anterior de Drepanepteryx; 34: ala anterior de Megalomus; 35: alas de Sympherobius; 36: alas de Hemerobius; 37: ala posterior de Wesmaelius; 38: alas de Psectra (ejemplar braquíptero); 39: ala anterior de Micromus. A diferentes escalas. Figs. 31-39.— Esquemas de los caracteres en la venación alar de diferentes géneros de hemeróbidos (para facilitar al lector su interpretación, se potencian los elementos idealizándolos al resaltarlos en negro): 31: base del campo costal de las alas anteriores sin vena humeral recurrente; 32: ídem, con vena humeral recurrente; 33: ala anterior de Drepanepteryx; 34: ala anterior de Megalomus; 35: alas de Sympherobius; 36: alas de Hemerobius; 37: ala posterior de Wesmaelius; 38: alas de Psectra (ejemplar braquíptero); 39: ala anterior de Micromus. A diferentes escalas.
Figs. 31-39.— Schemes of characters in the venation of different brown-lacewings genres (to facilitate the reader’s interpretation, the idealized elements are highlighted in black): 31: base of costal area of the forewing without recurrent humeral vein; 32: ditto, with recurrent humeral vein; 33: forewing of Drepanepteryx; 34: forewing of Megalomus; 35: Sympherobius wings; 36: Hemerobius wings; 37: hind wing of Wesmaelius; 38: Psectra wings (brachypterous exemplar); 39: fore wing of Micromus. At different scales.
| |
|
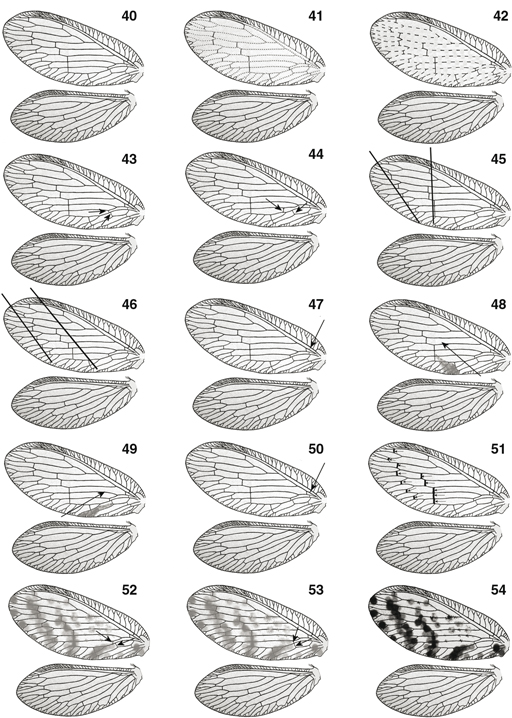 Figs. 40-54.— Esquemas idealizados de las alas de Hemerobius spp., donde se señalan los caracteres a seguir para la identificación de las especies ibérico-baleares del género. Figs. 40-54.— Esquemas idealizados de las alas de Hemerobius spp., donde se señalan los caracteres a seguir para la identificación de las especies ibérico-baleares del género.
Figs. 40-54.— Idealized schemes of Hemerobius spp. wings, where characters that are useful to identify the Ibero-Balearic species of the genus are pointed out.
| |
|
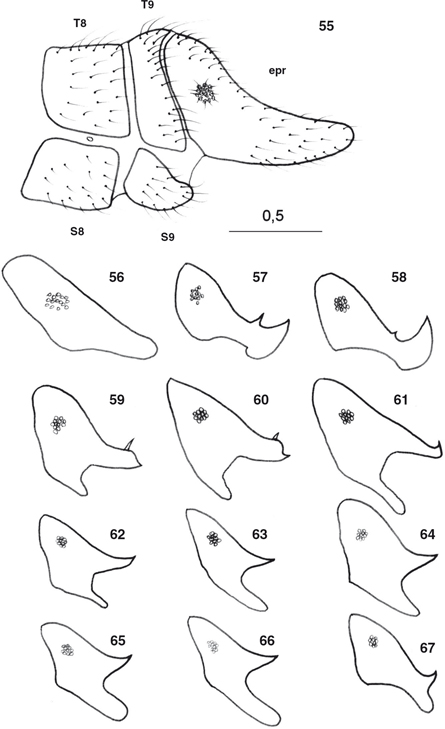 Figs. 55-67.— Esquema de la genitalia masculina y ectoprocto de Hemerobius spp., vista lateral: 55: H. marginatus; 56: H. bolivari; 57: H. lutescens; 58: H. gilvus; 59: H. humulinus; 60: H. perelegans; 61: H. simulans; 62: H. stigma; 63: H. pini; 64: H. contumax; 65: H. nitidulus; 66: H. handschini; 67: H. micans (epr: ectoprocto, S: esternito, T: terguito). Escala en mm para todas las figuras. Figs. 55-67.— Esquema de la genitalia masculina y ectoprocto de Hemerobius spp., vista lateral: 55: H. marginatus; 56: H. bolivari; 57: H. lutescens; 58: H. gilvus; 59: H. humulinus; 60: H. perelegans; 61: H. simulans; 62: H. stigma; 63: H. pini; 64: H. contumax; 65: H. nitidulus; 66: H. handschini; 67: H. micans (epr: ectoprocto, S: esternito, T: terguito). Escala en mm para todas las figuras.
Figs. 55-67.— Schemes of Hemerobius spp. male genitalia and ectoproct, lateral view: 55: H. marginatus; 56: H. bolivari; 57: H. lutescens; 58: H. gilvus; 59: H. humulinus; 60: H. perelegans; 61: H. simulans; 62: H. stigma; 63: H. pini; 64: H. contumax; 65: H. nitidulus; 66: H. handschini; 67: H. micans (epr: ectoproct, S: sternite, T: tergite). Scale in mm for all figures.
| |
|
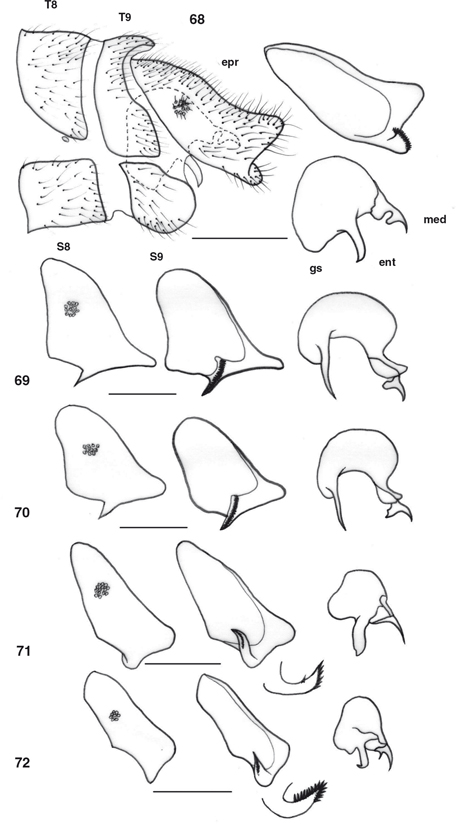 Figs. 68-72.— Esquemas de la genitalia masculina de Wesmaelius spp., vista lateral externa, vista lateral interna del ectoprocto y vista lateral del complejo gonarco-mediunco-entoprocesos: 68: W. fassnidgei; 69: W. concinnus; 70: W. quadrifasciatus; 71: W. ravus (ampliado extremo interno del ectoprocto en vista caudo-ventral); 72: W. navasi (ampliado extremo interno del ectoprocto en vista caudo-ventral) (ent: entoprocesos, epr: ectoprocto, gs: gonarco, med: mediunco, S: esternito, T: terguito). Escala 0,5 mm para todas las figuras. Figs. 68-72.— Esquemas de la genitalia masculina de Wesmaelius spp., vista lateral externa, vista lateral interna del ectoprocto y vista lateral del complejo gonarco-mediunco-entoprocesos: 68: W. fassnidgei; 69: W. concinnus; 70: W. quadrifasciatus; 71: W. ravus (ampliado extremo interno del ectoprocto en vista caudo-ventral); 72: W. navasi (ampliado extremo interno del ectoprocto en vista caudo-ventral) (ent: entoprocesos, epr: ectoprocto, gs: gonarco, med: mediunco, S: esternito, T: terguito). Escala 0,5 mm para todas las figuras.
Figs. 68-72.— Schemes of Wesmaelius spp. male genitalia, external lateral view, inner lateral view of ectoproct and lateral view of gonarcus-mediuncus-entoprocessus complex: 68: W. fassnidgei; 69: W. concinnus; 70: W. quadrifasciatus; 71: W. ravus (magnified inner apex of ectoproct in caudo-ventral view); 72: W. navasi (magnified inner apex of ectoproct in caudo-ventral view) (ent: entoprocessus, epr: ectoproct, gs: gonarcus, med: mediuncus, S: sternite, T: tergite). Scale 0.5 mm for all figures.
| |
|
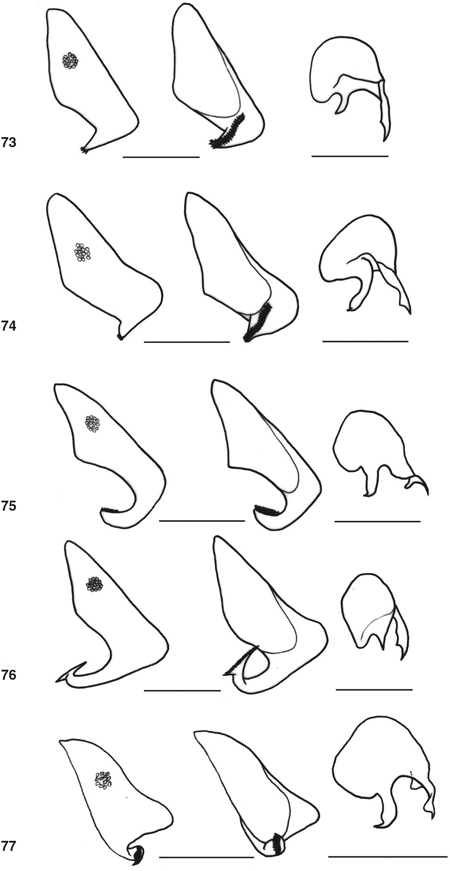 Figs. 73-77.— Esquemas de la genitalia masculina de Wesmaelius spp., ectoprocto en vista lateral externa, ectoprocto en vista lateral interna y vista lateral del complejo gonarco-mediunco-entoprocesos: 73: W. malladai; 74: W. helveticus; 75: W. nervosus; 76: W. subnebulosus; 77: W. reisseri. Escala 0,5 mm para todas las figuras. Figs. 73-77.— Esquemas de la genitalia masculina de Wesmaelius spp., ectoprocto en vista lateral externa, ectoprocto en vista lateral interna y vista lateral del complejo gonarco-mediunco-entoprocesos: 73: W. malladai; 74: W. helveticus; 75: W. nervosus; 76: W. subnebulosus; 77: W. reisseri. Escala 0,5 mm para todas las figuras.
Figs. 73-77.— Schemes of Wesmaelius spp. male genitalia, external lateral view of ectoproct, inner lateral view of ectoproct and lateral view of gonarcus-mediuncus-entoprocessus complex: 73: W. malladai; 74: W. helveticus; 75: W. nervosus; 76: W. subnebulosus; 77: W. reisseri. Scale 0.5 mm for all figures.
| |
|
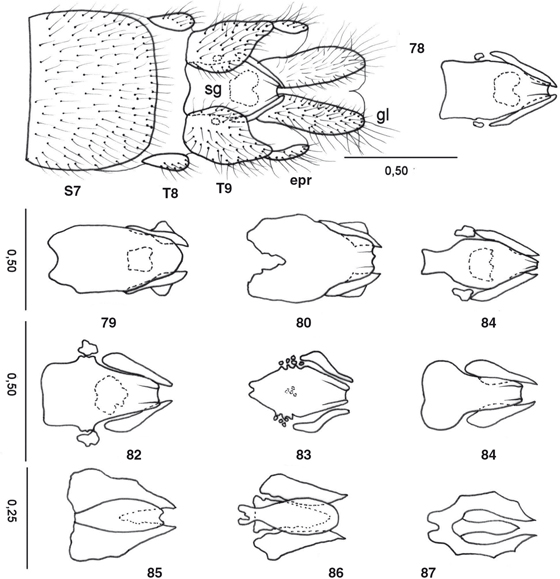 Figs. 78-87.— Esquemas de la genitalia femenina y placa subgenital en vista ventral de Wesmaelius spp.: 78: W. helveticus; 79: W. concinnus; 80: W. quadrifasciatus; 81: W. fassnidgei; 82: W. nervosus; 83: W. reisseri; 84: W. malladai; 85: W. subnebulosus; 86: W. navasi; 87: W. ravus (epr: ectoprocto, gl: gonapófisis laterales, S: esternito, sg: placa subgenital, T: terguito). Escala en mm para todas las figuras. Figs. 78-87.— Esquemas de la genitalia femenina y placa subgenital en vista ventral de Wesmaelius spp.: 78: W. helveticus; 79: W. concinnus; 80: W. quadrifasciatus; 81: W. fassnidgei; 82: W. nervosus; 83: W. reisseri; 84: W. malladai; 85: W. subnebulosus; 86: W. navasi; 87: W. ravus (epr: ectoprocto, gl: gonapófisis laterales, S: esternito, sg: placa subgenital, T: terguito). Escala en mm para todas las figuras.
Figs. 78-87.— Schemes of Wesmaelius spp. female genitalia and subgenital plate in ventral view: 78: W. helveticus; 79: W. concinnus; 80: W. quadrifasciatus; 81: W. fassnidgei; 82: W. nervosus; 83: W. reisseri; 84: W. malladai; 85: W. subnebulosus; 86: W. navasi; 87: W. ravus (epr: ectoproct, gl: lateral gonapophisses, S: esternite, sg: subgenital plate, T: tergite). Scale in mm for all figures.
| |
|
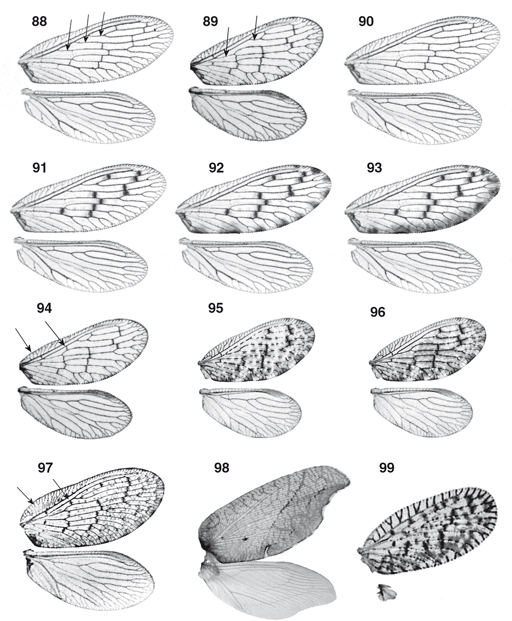 Figs. 88-99.— 88-95: Esquemas idealizados de las alas de Sympherobius spp., donde se señalan y potencian los caracteres a seguir para la identificación de las especies ibero-baleares del género. 88: especies de alas anteriores con tres ramas en el sector del radio; 89: especies de alas anteriores con dos ramas en el sector del radio; 90: S. fuscescens; 91: S. klapaleki; 92: S. riudori; 93: S. pellucidus; 94: S. fallax; 95: S. pygmaeus. 96-99: Alas de: 96: Sympherobius elegans; 97: Sympherobius gayi; 98: Drepanepteryx phalaenoides; 99: ejemplar braquíptero de Psectra diptera. A diferentes escalas. Según Monserrat (1998, 2004, 2011). Figs. 88-99.— 88-95: Esquemas idealizados de las alas de Sympherobius spp., donde se señalan y potencian los caracteres a seguir para la identificación de las especies ibero-baleares del género. 88: especies de alas anteriores con tres ramas en el sector del radio; 89: especies de alas anteriores con dos ramas en el sector del radio; 90: S. fuscescens; 91: S. klapaleki; 92: S. riudori; 93: S. pellucidus; 94: S. fallax; 95: S. pygmaeus. 96-99: Alas de: 96: Sympherobius elegans; 97: Sympherobius gayi; 98: Drepanepteryx phalaenoides; 99: ejemplar braquíptero de Psectra diptera. A diferentes escalas. Según Monserrat (1998, 2004, 2011).
Figs. 88-99.— 88-95: Idealized schemes of Sympherobius spp. wings, where characters are drawn and highlighted to facilitate the identification of Ibero-Balearic species of the genus. 88: species with three radial sectors in fore-wings; 89: species with two radial sectors in fore-wings; 90: S. fuscescens; 91: S. klapaleki; 92: S. riudori; 93: S. pellucidus; 94: S. fallax; 95: S. pygmaeus. 96-99: Wings of: 96: Sympherobius elegans; 97: Sympherobius gayi; 98: Drepanepteryx phalaenoides; 99: brachipteran specimen of Psectra diptera. At different scales. From Monserrat (1998, 2004, 2011).
| |
Género Hemerobius
| 1 |
Alas anteriores carentes de manchas más oscuras sobre la membrana o la venación (Figs. 8, 40-42) |
|
2 |
| - |
Alas anteriores con alguna mancha más oscura sobre la membrana o la venación (Figs. 4, 48, 49, 51-54) |
|
4 |
| 2 |
Venación de las alas anteriores alternativamente pigmentada con cortos tramos pálidos y oscuros (Figs. 8, 42), ectoprocto masculino según fig. 67 |
|
H. micans |
| - |
Venación de las alas anteriores pálida, regularmente pigmentada con tenues puntos más oscuros donde se inserta una seda (Fig. 41) |
|
3 |
| 3 |
Región anterior de la cabeza parda, ectoprocto masculino según fig. 65 |
|
H. nitidulus |
| - |
Región anterior de la cabeza negra, ectoprocto masculino según fig. 66 |
|
H. handschini |
| 4 |
Región central del tórax y abdomen en su región dorsal sin una banda media más pálida, sino uniformemente parda, ectoprocto masculino según fig. 62 |
|
H. stigma |
| - |
Región central del tórax y abdomen en su región dorsal con una banda media más pálida que el resto pardo (Fig. 4) |
|
5 |
| 5 |
Alas anteriores con abundantes manchas más oscuras, algunas contactando con el margen alar (Figs. 48, 49, 52-54) |
|
6 |
| - |
Alas anteriores con abundantes sombras más oscuras sobre las gradadas, pero sin que alguna contacte con el margen alar (Fig. 51) |
|
11 |
| 6 |
En las alas anteriores la venilla basal entre M y CU contacta tras la bifurcación de esta última (Fig. 44), ectoprocto masculino según fig. 61 |
|
H. simulans |
| - |
En las alas anteriores la venilla basal entre M y CU contacta antes de la bifurcación de esta última (Figs. 14, 43) |
|
7 |
| 7 |
En las alas anteriores la venilla basal entre Sc y R es parda pálida (Fig. 47) |
|
8 |
| - |
En las alas anteriores la venilla basal entre Sc y R es negra oscura (Fig. 50) |
|
9 |
| 8 |
En las alas anteriores la mancha oscura sobre el campo cubital se orienta hacia el extremo distal del ala (Figs. 4, 48), ectoprocto masculino según fig. 58 |
|
H. gilvus |
| - |
En las alas anteriores la mancha oscura sobre el campo cubital se orienta hacia la base del ala (Fig. 49), ectoprocto masculino según fig. 57 |
|
H. lutescens |
| 9 |
En las alas anteriores las venillas entre M-CUa y entre CUa-CUp no son ni paralelas ni coincidentes (Fig. 52), ectoprocto masculino según fig. 56 |
|
H. bolivari |
| - |
En las alas anteriores las venillas entre M-CUa y entre CUa-CUp son paralelas y casi siempre coincidentes (Figs. 14, 53, 54) |
|
10 |
| 10 |
Manchas de las alas anteriores fuertemente contrastadas (Fig. 54), ectoprocto masculino según fig. 60 |
|
H. perelegans |
| - |
Manchas de las alas anteriores débilmemente contrastadas (Fig. 53), ectoprocto masculino según fig. 59 |
|
H. humulinus |
| 11 |
En las alas anteriores las venillas gradadas tienen trayectorias divergentes (Fig. 45), ectoprocto masculino según fig. 63 |
|
H. pini |
| - |
En las alas anteriores las venillas gradadas tienen trayectorias paralelas (Fig. 46), ectoprocto masculino según fig. 64 |
|
H. contumax |
Género Wesmaelius
(Aunque anotamos algunos datos complementarios de morfología, coloración y biología, la genitalia es necesaria para la identificación específica en ambos sexos).
| 1 |
Alas anteriores anchas, con amplio campo costal, y habitualmente con 4 (a veces 5) ramas del SR. En las alas posteriores la venilla basal entre R y SR+Ma se sitúa en posición distal a la primera rama del SR. Genitalia masculina con ectoprocto triangular, apuntado caudalmente y portador de un dentículo ventral (Figs. 69, 70) |
|
Wesmaelius (Wesmaelius) 2 |
| - |
Alas anteriores más alargadas, con campo costal estrecho, y habitualmente con 3 (muy ocasionalmente 4) ramas del SR. En las alas posteriores la venilla basal entre R y SR+Ma se sitúa en posición basal a la primera rama del SR. Genitalia masculina con ectoprocto más cuadrangular, no apuntado caudalmente y portador de un proceso más o menos digitiforme (Figs. 68, 71-77) |
|
Wesmaelius (Kimminsia) 3 |
| 2 |
Tórax uniformemente pardo, sin una banda media dorsal más pálida. Alas anteriores débilmente manchadas de pardo pálido en las inmediaciones de sus venillas transversales y su margen externo, y venas longitudinales portando pequeñas puntuaciones más oscuras. Genitalia masculina según fig. 69, placa subgenital de la genitalia femenina según fig. 79 |
|
Wesmaelius (Wesmaelius) concinnus |
| - |
Tórax pardo con una banda media dorsal más pálida. Alas anteriores fuertemente manchadas de pardo oscuro, ampliamente extendidas a ambos lados de sus venillas transversales y su margen externo, y venas longitudinales portando pequeñas estrías más oscuras. Genitalia masculina según fig. 70, placa subgenital de la genitalia femenina según fig. 80 |
|
Wesmaelius (Wesmaelius) quadrifasciatus |
| 3 |
Alas anteriores con membrana pardo/canela muy pálida y muy débilmente manchada algo más oscuro en las inmediaciones de sus venillas transversales y su margen externo. Genitalia masculina con proceso distal del ectoprocto portador de dentículos bien individualizados según figs. 71, 72, placa subgenital de la genitalia femenina según figs. 86, 87 |
|
4 |
| - |
Alas anteriores con membrana parda fuertemente manchada de más oscuro en las inmediaciones de sus venillas transversales y su margen externo. Genitalia masculina con proceso distal del ectoprocto portador de muy pequeños dentículos no individualizados según figs. 68, 73-77, placa subgenital de la genitalia femenina según figs. 78, 81-85 |
|
5 |
| 4 |
Especie asociada a medios litorales, xéricos y térmicos. Genitalia masculina con proceso distal del ectoprocto portando un penacho cónico de dentículos en hilera contínua y mediuncus portador de un dentículo ventral según fig. 72, placa subgenital de la genitalia femenina según fig. 86 |
|
Wesmaelius (Kimminsia) navasi |
| - |
Especie de alta montaña. Genitalia masculina con proceso distal del ectoprocto portando un dentículo basal aislado de los restantes distales y mediuncus sin dentículo ventral según fig. 71, placa subgenital de la genitalia femenina según fig. 87 |
|
Wesmaelius (Kimminsia) ravus |
| 5 |
Proceso distal del ecoprocto en la genitalia masculina largo y digitiforme según figs. 75, 76, placa subgenital de la genitalia femenina según figs. 82, 85 |
|
6 |
| - |
Proceso distal del ecoprocto en la genitalia masculina corto o triangular según figs. 68, 73, 74, 77, placa subgenital de la genitalia femenina según figs. 78, 81, 83, 84 |
|
7 |
| 6 |
Proceso distal del ecoprocto en la genitalia masculina acabado en forma de anzuelo según fig. 76, placa subgenital de la genitalia femenina según fig. 85 |
|
Wesmaelius (Kimminsia) subnebulosus |
| - |
Proceso distal del ecoprocto en la genitalia masculina acabado en forma roma según fig. 75, placa subgenital de la genitalia femenina según fig. 82 |
|
Wesmaelius (Kimminsia) nervosus |
| 7 |
Proceso distal del ecoprocto en la genitalia masculina espatulado y recurvado hacia el interior según figs. 68, 77, placa subgenital de la genitalia femenina según figs. 81, 83 |
|
8 |
| - |
Proceso distal del ecoprocto en la genitalia masculina recto y cónico según figs. 73, 74, placa subgenital de la genitalia femenina según figs. 78, 84 |
|
9 |
| 8 |
Genitalia masculina con mediunco portador de una fuerte escotadura ventral según fig. 68, placa subgenital de la genitalia femenina según fig. 81 |
|
Wesmaelius (Kimminsia) fassnidgei |
| - |
Genitalia masculina con mediunco sin escotadura ventral según fig. 77, placa subgenital de la genitalia femenina según fig. 83 |
|
Wesmaelius (Kimminsia) reisseri |
| 9 |
Proceso distal del ecoprocto en la genitalia masculina algo más corto que su margen inferior según fig. 73, placa subgenital de la genitalia femenina según fig. 84 |
|
Wesmaelius (Kimminsia) malladai |
| - |
Proceso distal del ecoprocto en la genitalia masculina mucho más corto que su margen inferior según fig. 74, placa subgenital de la genitalia femenina según fig. 78 |
|
Wesmaelius (Kimminsia) helveticus |
Género Sympherobius
| 1 |
Alas anteriores elípticas, con tres sectores del radio (Fig. 88) |
|
2 |
| - |
Alas anteriores ovoides, con dos sectores del radio (Fig. 89) |
|
5 |
| 2 |
Alas anteriores sin sombras oscuras sobre la membrana a ambos lados de las venas gradadas (Fig. 90). Genitalia masculina según fig. 103 |
|
S. fuscescens |
| - |
Alas anteriores con sombras oscuras sobre la membrana a ambos lados de las venas gradadas (Figs. 91-93) |
|
3 |
| 3 |
Escapo y pedicelo mucho más pálidos que el más pardo flagelo. Alas anteriores apenas sin sombras oscuras sobre el margen posterior de la membrana (Fig. 91). Genitalia masculina según fig. 100 |
|
S. klapaleki |
| - |
Escapo y pedicelo igual de oscuros que el flagelo. Alas anteriores con sombras oscuras sobre el margen posterior de la membrana (Figs. 92, 93) |
|
4 |
| 4 |
Alas anteriores con sombras oscuras más o menos contínuas sobre el margen posterior de la membrana (Fig. 93). Genitalia masculina según fig. 104 |
|
S. pellucidus |
| - |
Alas anteriores con sombras oscuras marcadamente discontínuas sobre el margen posterior de la membrana (Fig. 92). Genitalia masculina según fig. 101 |
|
S. riudori |
| 5 |
Alas anteriores con una venilla entre el radio y la horquilla de su primer sector (Figs. 94, 97) |
|
6 |
| - |
Alas anteriores sin una venilla entre el radio y la horquilla de su primer sector (Figs. 95, 96) |
|
7 |
| 6 |
Alas anteriores anchas y ovoides, con campo costal fuertemente convexo y dilatado en la base del ala (Fig. 97). Membrana alar fuertemente variegada (Fig. 97). Genitalia masculina según fig. 107 |
|
S.gayi |
| - |
Alas anteriores más estrechas y elípticas, con campo costal escasamente convexo y apenas dilatado en la base del ala (Fig. 94). Membrana alar escasamente variegada, sólo intensamente a ambos lados de las venillas transversales y el margen posterior (Figs. 1, 2, 94). Genitalia masculina según fig. 102 |
|
S. fallax |
| 7 |
Flagelo pardo, solo levemente más pálido hacia el ápice. Alas anteriores con venación parda contínua, sin tramos más pálidos (Fig. 96). Genitalia masculina según fig. 105 |
|
S. elegans* |
| - |
Flagelo pardo en sus tercios basal y apical, y más pálido hacia el centro. Alas anteriores con venación parda discontínua, con tramos más pálidos (Fig. 95). Genitalia masculina según fig. 106 |
|
S. pygmaeus* |
|
*Especies de pigmentación muy variable, los datos que se anotan corresponden a ejemplares “típicos”. |
|
|
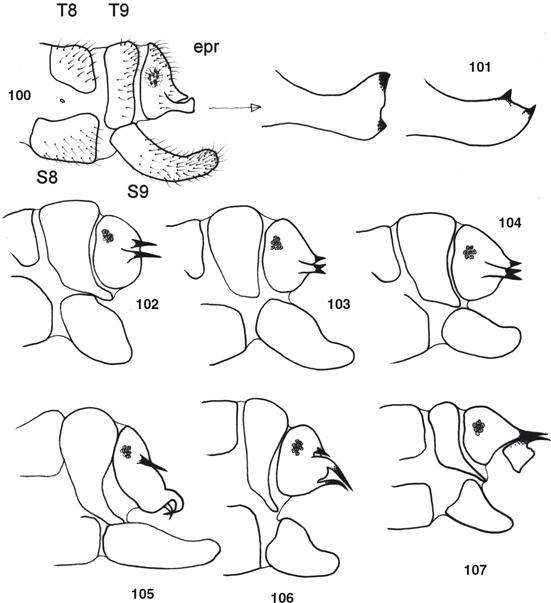 Figs. 100-107.— Esquemas de la genitalia masculina de Sympherobius spp., vista lateral: 100: S. klapaleki, ampliado proceso externo del ectoprocto; 101: proceso externo del ectoprocto de S. riudori; 102: S. fallax; 103: S. fuscescens; 104: S. pellucidus; 105: S. elegans; 106: S. pygmaeus; 107: S. gayi. (epr: ectoprocto, S: esternito, T: terguito). A diferentes escalas. Figs. 100-107.— Esquemas de la genitalia masculina de Sympherobius spp., vista lateral: 100: S. klapaleki, ampliado proceso externo del ectoprocto; 101: proceso externo del ectoprocto de S. riudori; 102: S. fallax; 103: S. fuscescens; 104: S. pellucidus; 105: S. elegans; 106: S. pygmaeus; 107: S. gayi. (epr: ectoprocto, S: esternito, T: terguito). A diferentes escalas.
Figs. 100-107.— Schemes of male genitalia of Sympherobius spp., lateral view. 100: S. klapaleki, magnified external processus of ectoproct; 101: external processus of ectoproct of S. riudori; 102: S. fallax; 103: S. fuscescens; 104: S. pellucidus; 105: S. elegans; 106: S. pygmaeus; 107: S. gayi. (epr: ectoproct, S: sternite, T: tergite). At different scales.
| |
Género Megalomus
(Únicamente los machos pueden identificarse con completa seguridad).
| 1 |
Alas fuertemente manchadas con sombras más oscuras, incluso las posteriores (Figs. 3, 108) |
|
2 |
| - |
Alas débilmente manchadas con sombras más oscuras, apenas las posteriores (Figs. 5, 109) |
|
3 |
| 2 |
Margen dorso caudal del ectoprocto del macho levemente convexo (Fig. 111) |
|
M. hirtus |
| - |
Margen dorso caudal del ectoprocto del macho fuertemente convexo (Fig. 110) |
|
M. tortricoides |
| 3 |
Extremo del ectoprocto del macho redondeado y romo, sin dientes (Fig. 113) |
|
M. pyraloides |
| - |
Extremo del ectoprocto del macho estrechado y acabado en varios dientes (Fig. 112) |
|
M. tineoides |
|
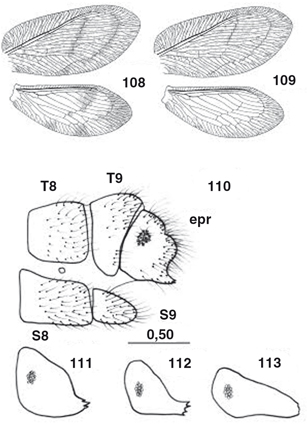 Figs. 108-113.— 108-109: Esquemas idealizados de las alas de Megalomus spp.: 108: con alas marcadamente manchadas; 109: con alas escasamente manchadas. Adaptado de Comstock (1918). 110-113: Esquema de genitalia masculina de Megalomus spp., vista lateral: 110: M. tortricoides; 111: M. hirtus; 112: M. tineoides; 113: M. pyraloides. (epr: ectoprocto, S: esternito, T: terguito). Escala en mm para las figuras 110-113. Figs. 108-113.— 108-109: Esquemas idealizados de las alas de Megalomus spp.: 108: con alas marcadamente manchadas; 109: con alas escasamente manchadas. Adaptado de Comstock (1918). 110-113: Esquema de genitalia masculina de Megalomus spp., vista lateral: 110: M. tortricoides; 111: M. hirtus; 112: M. tineoides; 113: M. pyraloides. (epr: ectoprocto, S: esternito, T: terguito). Escala en mm para las figuras 110-113.
Figs. 108-113.— 108-109: Idealized schemes of Megalomus spp.: 108: with markedly shaded wings; 109: with sparsely shaded wings. Adapted from Comstock (1918). 110-113: Schemes of male genitalia of Megalomus spp., lateral view: 110: M. tortricoides; 111: M. hirtus; 112: M. tineoides; 113: M. pyraloides. (epr: ectoproct, S: sternite, T: tergite). Scale in mm for figures 110-113.
| |
Género Micromus
| 1 |
Alas alargadas y estrechas, con membrana hialina y con abundantes sombras aisladas más oscuras (Fig. 7), alas anteriores con 3 ramas del SR. En las alas posteriores Mp fusionada por un tramo con Cua. Genitalia masculina según fig. 115 |
|
M. variegatus |
| - |
Alas ovales, pardo- amarillentas, membrana con abundantes sombras más oscuras formando líneas más o menos irregulares (Figs. 6, 9), las anteriores con 4 o más ramas del SR (Fig. 39). En las alas posteriores Mp no fusionada por un tramo con Cua |
|
2 |
| 2 |
Alas anteriores con 4 ramas del SR (Fig. 39), membrana parda fuertemente variegada de más oscuro y manchas pardas formando dibujos irregulares en forma de V (Figs. 6, 9). Genitalia masculina según fig. 117 |
|
M. angulatus |
| - |
Alas anteriores con más de 4 ramas del SR (5 o más, muy raramente 4), membrana pardo-pálida escasamente punteada de más oscuro y manchas pardas formando dibujos irregulares de aspecto variegado |
|
3 |
| 3 |
Alas anteriores con manchas pardas fuertemente contrastadas. Alas posteriores con venación y membrana hialina, sin sombra parda sobre las gradadas externas y venas adyacentes. Genitalia masculina según fig. 116 |
|
M. lanosus |
| - |
Alas anteriores con manchas pardas escasamente contrastadas. Alas posteriores con venación y membrana hialina, pero con sombra parda sobre las gradadas externas y venas adyacentes. Genitalia masculina según fig. 114 |
|
M. paganus |
|
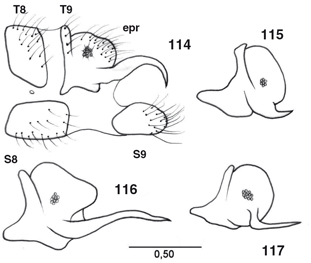 Figs. 114-117.— Esquema de genitalia masculina de Micromus spp., vista lateral: 114: M. paganus; 115: M. variegatus; 116: M. lanosus; 117: M. angulatus. (epr: ectoprocto, S: esternito, T: terguito). Escala en mm para todas las figuras. Figs. 114-117.— Esquema de genitalia masculina de Micromus spp., vista lateral: 114: M. paganus; 115: M. variegatus; 116: M. lanosus; 117: M. angulatus. (epr: ectoprocto, S: esternito, T: terguito). Escala en mm para todas las figuras.
Figs. 114-117.— Schemes of male genitalia of Micromus spp., lateral view: 114: M. paganus; 115: M. variegatus; 116: M. lanosus; 117: M. angulatus. (epr: ectoproct, S: sternite, T: tergite). Scale in mm for all figures.
| |
Género Drepanepteryx
Especie única: D. phalaenoides (Figs. 11, 33, 98)
Género Psectra
Especie única: P. diptera (Figs. 15, 38, 99)
Clave a nivel de género de las larvas de Hemerobiidae de la Península Ibérica e Islas Baleares
En función de los datos disponibles, las larvas de las especies de esta familia sólo pueden diferenciarse con seguridad a partir del segundo estadío (sin empodio en forma de embudo). Obviamente la quetotaxia cefálica y tegumentaria es diagnóstica a nivel de género, y muchas especies poseen en vivo caracteres de pigmentación que son utilizados para su diferenciación específica (Figs. 12, 21-28). Dado que la coloración (no estructural) se pierde en material conservado en alcohol y el acceso a la quetotaxia requiere cierta experiencia, hemos preferido aportar una clave general a nivel de género, utilizando caracteres sencillos fácilmente accesibles. Para el lector interesado, en cada especie se pormenoriza la información disponible sobre sus estados preimaginales. Más información en Gepp (1984, 1986), Veenstra et al. (1990) y Oswald & Tauber (2001).
| 1 |
Antenas de notable mayor longitud que el ancho de la cabeza (Figs. 12, 19, 21-24, 26-28) |
|
3 |
| - |
Antenas de menor o igual longitud que el ancho de la cabeza (Figs. 20, 25) |
|
2 |
| 2 |
Palpo labial apenas más largo que la mandíbula (Fig. 20) |
|
Sympherobius |
| - |
Palpo labial notablemente más largo que la mandíbula (Fig. 25) |
|
Psectra |
| 3 |
Antenas tanto o más del doble de largas que la anchura de la cabeza (Figs. 21, 22) |
|
Micromus |
| - |
Antenas menos del doble de largas que la anchura de la cabeza (Figs. 12, 19, 23, 24, 26-28) |
|
4 |
| 4 |
Mandíbulas una vez y media más largas que la anchura cefálica (Figs. 12, 23) |
|
Wesmaelius (Wesmaelius) |
| - |
Mandíbulas como mucho tan largas o más cortas que la anchura cefálica (Figs. 19, 24, 26-28) |
|
5 |
| 5 |
Palpo labial más largo y más ancho que la mandíbula (Fig. 24) |
|
Megalomus |
| - |
Palpo labial de similar longitud y anchura o más corto y estrecho que la mandíbula (Figs. 19, 26-28) |
|
6 |
| 6 |
Maxilas más del doble del grosor de las mandíbulas hacia la mitad de su longitud (Figs. 28) |
|
Wesmaelius (Kimminsia) |
| - |
Maxilas como máximo 1,8 veces más gruesas que las mandíbulas hacia la mitad de su longitud (Figs. 19, 26, 27) |
|
7 |
| 7 |
Longitud de las patas anteriores casi 2 veces la de cabeza + mandíbulas (Fig. 26) |
|
Drepanepteryx |
| - |
Longitud de las patas anteriores entre 1 y 1,5 veces la de cabeza + mandíbulas (Figs. 27) |
|
Hemerobius |
Las especies de Hemerobiidae de la Península ibérica y Baleares
Hemerobiinae Latreille, 1802
Hemerobius (Hemerobius) humulinus Linnaeus, 1758 (Figs. 14, 59)
Aspöck et al., 1980: 210 (rf); Monserrat, 1985c: 91 (bio, dis), 1986a: 1204 (bio, dis); Marín & Monserrat, 1989: 291 (bio, dis); Canard et al., 1992: 96 (dis); Monserrat et al., 1994: 46 (bio, dis); Monserrat, 1996b: 13 (list); H. Aspöck et al., 2001: 127 (rf); Whittington, 2002: 380 (rf); Monserrat & Triviño, 2013: 16 (list), 56 (dis).
Hemerobius humilis Linnaeus, 1758
Navás, 1928a: 45 (dis); Monserrat & Triviño, 2013: 16 (list).
Hemerobius humuli Linnaeus, 1761
Brauer, 1876: 277 (rf); Navás, 1904a: 125 (dis); Morton, 1912: 113 (dis); Navás, 1915a: 50 (dis), 1916a: 173 (dis), 1917b: 87 (dis), 1919a: 194 (dis), 1924a: 108 (rf), 1924b: 201 (key), 210 (dis, mf), 1924c: 129 (dis), 1925a: 98 (key), 103 (dis, mf); Nagler, 1958: 302 (rf); Monserrat & Triviño, 2013: 16 (list).
Hemerobius humulinus Linnaeus, 1758
Killington, 1937: 11 (rf); Throne, 1971: 80 (rf); Canard & Laudého, 1977: 72 (rf); Monserrat, 1978a: 176 (bio, dis), 1980b: 184 (bio, dis), 1984a: 46 (rf), 1990b: 82 (dis), 1991b: 106 (bio, dis); Marín & Monserrat, 1991b: 192 (bio, dis); Monserrat, 1994: 18 (bio, dis); Monserrat & Marín, 1996a: 777-785 (bio); Ribeiro, 1997: 258 (dis); Monserrat & Marín, 2001: 424-431 (bio, dis); Monserrat, 2004: 3 (bio, dis), 2008a: 235 (bio, dis); Ocharan et al., 2012: 424 (bio, dis); Letardi et al., 2013: 36 (list); Monserrat & Triviño, 2013: 16 (list); Monserrat et al., 2013a: 52 (bio, dis), 2013b: 160 (bio, dis).
Hemerobius humilinus Linnaeus, 1758 (lapsus)
Monserrat, 1984a: 46 (rf).
Elemento holártico extendido desde Macaronesia a Japón, y en América desde Alaska a Guatemala. Parece ser relativamente euroica, aunque es más frecuente en zonas boscosas y húmedas, y está citada sobre gran variedad de plantas, a veces coníferas, pero generalmente planifolios, y robles, avellanos, sauces, abedules, alisos, fresnos, arces, olmos y hayas en particular (la cita de Ribeiro, 1997 sobre Quercus coccifera en Alcobaça nos parece, cuanto menos, sorprendente). Está mayoritariamente citada entre III-X, en altitudes de hasta 2040 m. En nuestra fauna tiene una clara tendencia eurosiberiana con citas puntuales más meridionales, y ha sido citada entre IV-X, en altitudes que oscilan entre 30-1500 m.
El huevo y las fases larvarias de esta especie fueron descritos por Smith (1923), Withycombe (1923), Killington (1936, 1937), Nakahara (1954 como H. obtusus) y Agekyan (1973).
Hemerobius (Hemerobius) nitidulus Fabricius, 1777 (Fig. 65)
Aspöck et al., 1980: 216 (rf); Monserrat, 1985c: 91 (bio, dis), 1986a: 1204 (bio, dis); Díaz-Aranda et al., 1986a: 1125 (bio, dis), 1986b: 1137 (bio, dis); Díaz-Aranda & Monserrat, 1988a: 117 (rf), 1988b: 222 (bio, dis); Monserrat & Díaz-Aranda, 1988: 90 (bio, dis), 1989: 51 (bio, dis); Marín & Monserrat, 1990: 224 (bio, dis); Marín & Monserrat, 1991a: 181 (bio, dis); Canard et al., 1992: 96 (dis); Monserrat et al., 1994: 46 (bio, dis); Marín & Monserrat, 1995a: 114 (bio, dis); Monserrat & Marín, 1996a: 777-785 (bio); Monserrat, 1996b: 13 (list); H. Aspöck et al., 2001: 133 (rf); Monserrat & Triviño, 2013: 16 (list), 57 (dis).
Hemerobius nitidulus Fabricius, 1777
Brauer, 1876: 291 (rf); Dziędzielewicz, 1891: 100 (rf); Navás, 1915a: 50 (dis), 1916b: 234 (dis), 1916d: 154 (dis), 1917c: 40 (dis); Bohigas & Sanchez, 1917: 316 (dis); Navás, 1918: 41 (dis), 1921a: 65 (dis), 1921b: 151 (dis), 1922a: 193 (dis), 1924a: 108 (rf), 1924b: 201 (key), 207 (dis, mf), 1924c: 129 (dis), 1925a: 97 (key), 101 (dis, mf), 1928b: 99 (dis); Killington, 1937: 52 (rf); Zelený, 1963: 62 (rf), 1964: 328 (rf); Ohm & Remane, 1968: 221 (dis); Monserrat, 1977: 17 (list), 92 (key), 93 (bio, dis), 97 (rf), 99 (rf), 1978a: 175 (bio, dis); Morgan, 1980: 119 (dis); Monserrat, 1980b: 184 (bio, dis), 1984a: 35 (bio, dis), 1984b: 174 (bio, dis), 1984e: 159 (bio, dis), 1986b: 103 (dis), 1991a: 68 (bio, dis), 1991b: 107 (bio, dis), 1994: 18 (dis); Marín, 1994: 254-302 (bio, dis); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio), 2001: 424-431 (bio, dis); Monserrat, 2004: 3 (dis), 2008a: 235 (bio, dis); Monserrat & Triviño, 2013: 16 (list); Letardi et al., 2013: 36 (list); Monserrat et al., 2013a: 52 (bio, dis), 2013b: 160 (bio, dis).
Hemerobius haematicus Navás, 1908
Navás, 1908: 118 (key), 119 (d); Monserrat & Triviño, 2013: 16 (list).
Algunas de las citas existentes en nuestra fauna son francamente dudosas y/o cuestionables.
Especie paleártica occidental conocida de Europa, Chipre, y en Asia desde Anatolia hasta Mongolia y Kamtschatka. Asociada a coníferas, especialmente Pinus, Picea y Larix. Recientemente se ha cuestionado molecularmente la identidad de esta especie respecto a H. handschini (Morinière et al., 2014). Está mayoritariamente citada entre IV-X, en altitudes de hasta 2400 m. En nuestra fauna posee una amplia distribución, y ha sido citada entre III-X, en altitudes que oscilan entre 120-2200 m.
El huevo de esta especie y sus estadios larvarios fueron descritos por Withycombe (1923), Killington (1936, 1937) y Bänsch (1964).
Hemerobius (Hemerobius) micans Olivier, 1792 (Figs. 8, 67)
Monserrat, 1985c: 91 (bio, dis), 1986a: 1205 (bio, dis); Díaz-Aranda et al., 1986a: 1125 (bio, dis), 1986b: 1137 (bio, dis); Marín & Monserrat, 1989: 291 (dis), 1990: 224 (bio, dis); Canard et al., 1992: 96 (dis); Monserrat et al., 1994: 47 (bio, dis); Marín & Monserrat, 1995a: 115 (bio, dis); Monserrat, 1996b: 13 (list), 2008a: 235 (bio, dis); Monserrat & Triviño, 2013: 16 (list), 57 (dis).
Hemerobius micans Olivier, 1792
Brauer, 1876: 291 (rf); Dziędzielewicz, 1891: 100 (rf); Navás, 1904b: 143 (dis); Lucas, 1906: 277 (dis); Navás, 1908: 118 (key), 119 (dis), 1909a: 175 (bio, dis), 1909b: 376 (dis), 1913a: 81 (dis), 1913b: 67 (dis), 1914b: 34 (dis), 1914c: 212 (bio, dis), 1916a: 173 (dis), 1916c: 189 (dis), 1917b: 87 (dis), 1919a: 194 (dis), 1919c: 42 (dis), 1922b: 109 (dis), 1923: 8 (dis), 1924a: 108 (rf), 1924b: 201 (key), 206 (dis, mf), 1924d: 25 (dis), 1925a: 97 (key), 101 (dis, mf), 1928b: 99 (dis); Mosely, 1932a: 282 (dis); Zelený, 1964: 327 (rf); Monserrat, 1977: 17 (list), 92 (key), 97 (rf), 1984a: 35 (bio, dis), 1986b: 103 (dis), 1990b: 82 (bio, dis), 1991b: 107 (bio, dis); Marín & Monserrat, 1991b: 192 (bio, dis); Monserrat, 1994: 18 (dis); Monserrat & Marín, 1996a: 777-785 (bio), 2001: 424-431 (bio, dis); Monserrat, 2004: 3 (bio, dis), 2008a: 235 (bio, dis); Ocharan et al., 2012: 424 (bio, dis); Monserrat & Triviño, 2013: 16 (list); Monserrat et al., 2013a: 52 (bio, dis), 2013b: 160 (bio, dis).
Hemerobius micans conspicua Navás, 1915
Navás, 1915c: 247 (dis), 1916c: 189 (dis), 1922b: 109 (dis), 1924b: 206 (dis, mf), 1925a: 101 (dis, mf); Monserrat, 1985a: 240 (tx); Monserrat & Triviño, 2013: 16 (list).
Hemerobius micans fuscinervis Stephens, 1836
Navás, 1915c: 248 (dis, mf), 1923: 8 (dis); Monserrat & Triviño, 2013: 16 (list).
Nuevo material estudiado: ESPAÑA: Guipúzcoa, Irún, Otzarte, Aiako Harria P.N., 30TWN9994, 500 m, 26.V.2014, 1♀ (Fig. 8), 6.VI.2014, 1♂, 1♀, 7.VII.2014, 1♂, 27.VII.2014, 1 m, todos sobre Quercus pyrenaica, S. Pagola.
Quizás por un lapsus, no está recogida de España o Portugal por Aspöck et al. (1980: 217) ni por H. Aspöck et al. (2001: 134).
Elemento sibérico occidental, conocido desde Europa hasta Anatolia, Armenia e Irán. Generalmente asociado a planifolios en medios húmedos, especialmente a Fagus sylvatica, a quien acompaña en su distribución (Fig. 8). Especie mayoritariamente citada entre III-XI, en altitudes de hasta 3200 m. En nuestra fauna tiene una clara tendencia eurosiberiana con citas puntuales algo más meridionales, ha sido citada entre IV-X, en altitudes que oscilan entre 120-2000 m.
El huevo y los estadios larvarios de esta especie fueron descritos por Withycombe (1923), Killington (1936, 1937) y Bänsch (1964).
Hemerobius (Hemerobius) lutescens Fabricius, 1793 (Fig. 57)
Aspöck et al., 1980: 218 (rf); Monserrat, 1985c: 91 (bio, dis), 1986a: 1205 (dis); Marín & Monserrat, 1989: 291 (dis); Canard et al., 1992: 96 (dis); Monserrat et al., 1994: 47 (bio, dis); Monserrat, 1996b: 13 (list); H. Aspöck et al., 2001: 135 (rf); Monserrat & Triviño, 2013: 16 (list), 56 (dis); Monserrat, 2013: 289 (rf).
Hemerobius lutescens Fabricius, 1793
Navás, 1914d: 188 (dis), 1915a: 50 (dis), 1916a: 173 (dis), 1916c: 189 (dis), 1917c: 40 (dis); Bohigas & Sanchez, 1917: 316 (dis); Navás, 1917b: 87 (dis), 1918: 41 (dis), 1919a: 194 (dis), 1921a: 65 (dis), 1921b: 151 (dis), 1922b: 109 (dis), 1923: 8 (dis), 1924a: 108 (rf), 1924b: 201 (key), 209 (dis, mf), 1924d: 25 (dis),1925a: 98 (key), 102 (dis, mf), 1925b: 135 (dis), 1927a: 97 (dis), 1932: 15 (dis); Monserrat, 1978a: 176 (bio, dis), 1984a: 35 (bio, dis), 1990b: 82 (bio, dis), 1991b: 107 (bio, dis), 2005: 76 (rf); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio), 2001: 424-431 (bio, dis); Ocharan et al., 2012: 424 (rf); Monserrat & Triviño, 2013: 16 (list); Monserrat et al., 2013b: 160 (bio, dis).
Especie paleártica occidental y central, conocida desde Europa y Anatolia al Cáucaso y Mongolia. Marcadamente euroica, está asociada a planifolios en medios húmedos. Está mayoritariamente citada sobre robles y otros planifolios, entre IV-X, en altitudes de hasta 2400 m. En nuestra fauna tiene una clara tendencia eurosiberiana con citas puntuales más meridionales, y ha sido citada entre V-IX, en altitudes que oscilan entre 10-1620 m.
El huevo y los estadios larvarios de esta especie fueron descritos por Withycombe (1923, 1925) y Killington (1937).
Hemerobius (Hemerobius) stigma Stephens, 1836 (Fig. 62)
Aspöck et al., 1980: 212 (rf); Monserrat, 1985c: 91 (bio, dis), 1986a: 1206 (bio, dis); Díaz-Aranda et al., 1986a: 1125 (bio, dis), 1986b: 1137 (bio, dis); Monserrat & Díaz-Aranda, 1987: 179 (bio, dis); Díaz-Aranda & Monserrat, 1988a: 117 (rf), 1988b: 222 (dis), 1988c: 219 (bio, dis); Monserrat & Díaz-Aranda, 1988: 91 (bio, dis), 1989: 51 (bio, dis); Marín & Monserrat, 1989: 292 (bio, dis), 1990: 224 (bio, dis), 1991a: 181 (bio, dis); Canard et al., 1992: 96 (dis); Monserrat et al., 1994: 47 (bio, dis); Marín & Monserrat, 1995a: 115 (bio, dis), 1995b: 38 (rf); Monserrat, 1996b: 13 (list); H. Aspöck et al., 2001: 130 (rf); Whittington, 2002: 380 (rf); Monserrat & Triviño, 2013: 16 (list), 59 (dis); Monserrat, 2013: 290 (rf).
Hemerobius stigma Stephens, 1836
McLachlan, 1899: 150 (dis), 1902a: 131 (dis); Navás, 1908: 119 (dis, key); King & Halbert, 1910: 75 (dis); Morton, 1912: 113 (dis); Navás, 1915b: 470 (dis, mf), 1916a: 173 (dis), 1917b: 87 (dis), 1917c: 40 (dis); 1918: 41 (dis), 1919a: 194 (dis), 1921a: 65 (dis), 1921b: 151 (dis), 1922b: 109 (dis), 1923: 8 (dis), 1924a: 108 (rf), 1924b: 201 (key), 211 (dis, mf), 1924c: 130 (dis), 1925a: 98 (key), 104 (bio, dis, mf); Nakahara, 1960a: 42 (rf); Zelený, 1963: 61 (rf); Monserrat, 1977: 17 (list), 92 (key), 98 (bio, dis), 1978a: 175 (bio, dis); Morgan, 1980: 119 (dis); Monserrat, 1980b: 184 (bio, dis), 1981: 153 (bio, dis), 1982: 75 (bio, dis), 1984a: 35 (bio, dis), 1984b: 174 (bio, dis), 1984d: 98 (bio, dis), 1984e: 160 (bio, dis); Monserrat, 1986a: 1218 (rf), 1986b: 104 (rf, tx), 1987: 135 (bio, dis), 1990b: 82 (bio, dis), 1991b: 108 (bio, dis), 1994: 19 (bio, dis); Marín, 1994: 254-302 (bio, dis); Monserrat & Marín, 1996a: 777-785 (bio), 2001: 424-431 (bio, dis); Mendel et al., 1997: 231 (bio, dis); Monserrat, 2004: 4 (bio, dis), 2005: 76 (rf); Branco et al., 2006a: 181 (dis), 2006b: 2 (dis); Monserrat, 2008a: 235 (bio, dis), 2011: 171 (bio, dis, tx), 172 (rf); Monserrat & Triviño, 2013: 16 (list); Letardi et al., 2013: 36 (list); Monserrat et al., 2013a: 52 (bio, dis), 2013b: 160 (bio, dis).
Hemerobius limbatus Wesmael, 1841
McLachlan, 1880: 107 (dis).
Hemerobius buissoni (Navás, 1909)
Navás, 1916d: 154 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Hemerobius buyssoni (Navás, 1909)
Bohigas & Sanchez, 1917: 316 (dis); Navás, 1917a: 165 (dis).
Hemerobius periphericus Navás, 1913
Navás, 1913a: 81 (d), 1924a: 108 (rf), 1924b: 201 (key), 212 (dis, mf), 1925a: 98 (key), 104 (dis); Monserrat, 1977: 17 (list), 92 (key), 97 (rf), 1985a: 240 (tx); Monserrat & Triviño, 2013: 16 (list).
Hemerobius (Hemerobius) canadai Navás, 1924
Monserrat, 1996b: 16 (rf, tx); Monserrat & Triviño, 2013: 16 (list).
Hemerobius canadai Navás, 1924
H. Aspöck et al., 2001: 316 (rf); Monserrat, 2011: 171 (tx); Monserrat & Triviño, 2013: 16 (list).
Hemerobius cañadai Navás, 1924 (lapsus)
Navás, 1924a: 106 (d), 1925a: 98 (key), 103 (bio, dis, mf), 1929a: 1421 (list); Monserrat, 1986a: 1218 (rf, tx), 2011: 171 (tx); Monserrat & Triviño, 2013: 16 (list).
Nuevo material estudiado: ESPAÑA: Granada, Acebuche, 287 m, 13.IV.2014, 2♂♂, 3♀♀ sobre Pinus halepensis, 1.IX.2014, 6♂♂, 3♀♀ sobre P. halepensis, Collado de la Sabina, 30SVG60, 2050 m, 18.VII.2014, 2♂♂, 3♀♀ sobre P. sylvestris, Presa de Rules 280 m, 13.IV.2014, 2♂♂, 3♀♀ sobre P. halepensis, 18.VII.2014, 6♂♂, 3♀♀ sobre P. halepensis, 1.IX.2014, 6♂♂, 3♀♀ sobre P. halepensis, 1.IX.2014, 9♂♂, 3♀♀ sobre P. halepensis, 1.IX.2014, 9♂♂, 3♀♀ sobre P. halepensis, Vélez de Benaudalla, 350 m, 13.IV.2014, 1♂, 3♀♀ sobre P. halepensis, 18.VII.2014, 6♂♂, 5♀♀ sobre P. halepensis, 1.IX.2014, 3♂♂, 6♀♀ sobre P. halepensis, 1.IX.2014, 3♂♂, 6♀♀ sobre P. halepensis. Madrid, El Escorial, Abantos, 19.VI.2014, 1♀ sobre P. sylvestris, F. Acevedo (VM). Málaga, Coín, 50 m, 1.V.2014, 6♂♂, 3♀♀ sobre P. halepensis, Frigiliana, 340 m, 2.V.2014, 6♂♂, 3♀♀ sobre P. halepensis, Maro, 2.V.2014, 2♂♂, 3♀♀ sobre P. halepensis, 1♂, 5♀♀ sobre P. halepensis, Pinos de Alhaurín, 220 m, 2.V.2014, 2♂♂, 6♀♀ sobre P. halepensis. Tarragona, La Selva del Camp, 41°13′0767″N 1°08′3694″E, 224 m, 16.XI.2007, 1♀, N. Cañellas, 16.XII.2007, 1♀, 20.X.2010, 1♀, todos sobre Citrus clementina, N. Cañellas.
Conviene indicar un par de cuestiones faunísticas y taxonómicas en relación con esta especie y sus abundantes citas y sinonimias. Por una parte, alguna de estas citas han sido cuestionadas, descartadas o corregidas, y así la de Navás (1918) fue asignada a Hemerobius contumax por Monserrat (1986b: 104) o la de Hemerobius marginatus Stephens, 1836 que refiere Monserrat (2011: 172) o la de Hemerobius strigosus Zetterstedt, 1840 de Navás (1905c), que comentaremos más adelante. Por otra parte debemos anotar que, al margen del controvertido historial taxonómico del género Hemerodomia Navás, 1909 y su especie tipo por monotipia: Hemerodomia buyssoni Navás, 1909 (Navás, 1909c; Banks, 1913b; Navás, 1917a; Nakahara, 1960a; Aspöck et al., 1980; Oswald & Penny, 1991; Oswald, 1993a; H. Aspöck et al., 2001; Oswald, 2013a), no asumimos la histórica asociación entre Hemerobius buyssoni (Navás, 1909) = Hemerodomia buyssoni Navás, 1909 y la especie que ahora tratamos (H. stigma), según anotaron Navás (1924b), Killington (1937), Nakahara (1960a), Barnard (1978), Aspöck et al. (1980), H. Aspöck et al. (2001) y Oswald (2013a). Es cierto que Navás (1917a) después de sinonimizar ambos géneros (Hemerobius y Hemerodomia) de una forma bastante sui géneris, y aportar nuevos elementos y dibujos sobre su presunta genitalia masculina, Navás (1916d, 1917a) inicialmente asigna a esta especie (H. buyssoni) ejemplares recolectados en Lérida sobre pinos y abetos, y posteriormente, utilizando los mismos dibujos, Navás (1924b, 1925a) sinonimiza ambas especies, y así esta sinonimia es recogida por los autores mencionados. Sin embargo, no nos parecen muy similares estos dibujos sobre la genitalia masculina (Navás, 1924b, 1925a) a lo conocido en H. stigma, asemejándose más a lo que conocemos en H. contumax (Figs. 62, 64). Es cierto que las interpretaciones que su autor hace sobre la genitalia de especies posteriormente sinonimizadas a H. stigma son bastante subjetivas y particulares (ver por ejemplo H. canadai Navás, 1924 en Monserrat, 1986a, 2011). Por otra parte, y tras estudiar la serie tipo de H. buyssoni, esta especie fue considerada sinónima de H. atrifrons McLachlan, 1868 por Leraut (1982), especie que, a su vez, recientemente se ha cuestionado molecularmente su identidad respecto a H. contumax Tjeder, 1932 (Morinière et al., 2014). El tipo de Hemerobius buyssoni (Navás, 1909) es de La Bourboule, departamento de Puy-de-Dôme, en la región de Auvergne, del centro de Francia, y los ejemplares que Navás (1916d, 1917a) asigna a esta especie son de San Juan del Yermo (Sant Joan de l’Erm) en Lérida, y si la opinión de Navás fuera acertada (cosa que dudamos), habría que asumir la presencia de H. atrifrons McLachlan, 1868 en nuestra fauna. Alguno de estos ejemplares citados por Navás (1916d, 1917a) fueron estudiados por Monserrat (1986c) asignándolos a H. contumax Tjeder, 1932, según hemos anotado al principio, y también, con idénticos datos de captura, Monserrat (2004) cita otros ejemplares de H. nitidulus o H. stigma. Lo más probable es que los ejemplares que cita Navás (1916d, 1917a, 1924b) se refieran a Hemerobius contumax Tjeder, 1932, que también ahora citamos de Pirineos de Huesca, Lérida y Navarra sobre pinos y abetos, descartando, por el momento, la presencia de H. atrifrons en nuestra fauna.
Especie holártica, conocida desde las Islas de Macaronesia a Japón y de Canadá a Estados Unidos (introducida en Hawái: Monserrat, 1991a). Mayoritariamente asociada a coníferas, especialmente a Pinus. Está citada a lo largo de todo el año, en altitudes de hasta 3200 m. En nuestra fauna posee una amplia distribución, mayoritariamente acompañando a las coníferas, bien espontáneas o de repoblación, y ha sido citada entre II-XI, en altitudes que oscilan entre 10-2900 m.
El huevo y sus estadios larvarios fueron descritos por Withycombe (1922b), Smith (1923, como H. stigmaterus), Killington (1936, 1937), Laidlaw (1936) y Miller & Lambdin (1982, 1984).
Hemerobius (Hemerobius) gilvus Stein, 1863 (Figs. 4, 58)
Aspöck et al., 1980: 218 (rf); Monserrat, 1985c: 92 (bio, dis), 1986a: 1207 (bio, dis, rf, tx); Díaz-Aranda et al., 1986b: 1137 (bio, dis); Marín & Monserrat, 1990: 225 (bio, dis); Canard et al., 1992: 96 (dis); Monserrat et al., 1994: 47 (bio, dis); Monserrat, 1996b: 13 (list); H. Aspöck et al., 2001: 136 (rf); Monserrat & Triviño, 2013: 16 (list), 55 (dis).
Hemerobius burmani Aspöck, 1963
Monserrat, 1978a: 176 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Hemerobius gilvus Stein, 1863
Monserrat, 1984a: 36 (bio, dis), 1984e: 160 (bio, dis), 1990b: 82 (bio, dis), 1991b: 108 (bio, dis), 1994: 19 (dis); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio), 2001: 424-431 (bio, dis); Monserrat, 2004: 4 (bio, dis), 2005: 76 (rf), 2008a: 236 (bio, dis); Monserrat & Triviño, 2013: 16 (list); Monserrat et al., 2013a: 52 (bio, dis), 2013b: 160 (bio, dis).
Hemerobius occiduus Navás, 1915
Navás, 1915c: 249 (d), 1916a: 173 (dis), 1924a: 108 (rf), 1924b: 201 (key), 208 (dis, mf), 1924c: 130 (dis), 1925a: 98 (key), 102 (dis, mf); Monserrat, 1990b: 82 (rf); Monserrat & Triviño, 2013: 16 (list).
Brauerobius marginatus (Stephens, 1836)
Monserrat, 1977: 17 (list), 102 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Como Brauerobius marginatus (Stephens, 1836) está erróneamente citada de Guadarrama por Monserrat (1977: 17, 102), cita que es corregida por Monserrat (1986a: 1207) y es asignada a la especie que tratamos.
Elemento mediterráneo, probablemente holomediterráneo, conocido de Europa, Chipre, Anatolia y Armenia. Generalmente asociado a planifolios del género Quercus y Corylus en medios relativamente húmedos. Es una especie mayoritariamente citada sobre planifolios, entre V-IX, en altitudes de hasta 1500 m. En nuestra fauna es conocida en la mitad septentrional de la península y ha sido citada entre V-IX, en altitudes que oscilan entre 20-2000 m.
El huevo de esta especie fue descrito por Stephens (1836) y Killington (1937).
Hemerobius (Hemerobius) bolivari Banks, 1910 (Figs. 19, 56)
Hemerobius bolivari Banks, 1910
Monserrat et al., 2013b: 159 (dis), 161 (bio, dis); Garcia et al., 2013: 253 (rf), 254 (bio, dis, rf), 255 (rf).
Nuevo material complementario estudiado: ARGENTINA: Río Negro, Cervantes, 39°2’42”S 67°27’22”W, XII-V 2011-2013, abundante material recolectado sobre perales, S. A. Garrido.
Especie frecuente, abundante, y en origen ampliamente distribuido por la Región Neotropical, desde México, Costa Rica, Guatemala y Panamá a Tierra del Fuego, Islas Malvinas y Archipiélago de Juan Fernández (Monserrat, 1996a, 1998, 2002, 2003, 2004, 2008a). Recientemente ha sido introducida, probablemente de forma accidental, en Portugal (Monserrat et al., 2013b; Garcia et al., 2013), donde se ha citado predando sobre ninfas de Thaumastocoris peregrinus Carpintero et Dellape, 2006 (Hemiptera: Thaumastocoridae) sobre Eucalyptus camaldulensis. Desconocemos si esta po-tencialmente invasora especie ha mantenido en nuestras latitudes sus poblaciones, lo cual es muy probable, debido a su versatilidad y amplitud de sustratos sobre las que ha sido hallada en su zona de origen (Pinus, Austrocedrus, Tepualia, Drimys, Crataegus, Prosopis, Chusquea, Desfontainia, Jordina, Tamarix, Schimus, Amomirthus, Luma, Pilgerodendron, Nothofagus, etc., incluso cultivos de Coffea arabica L., Zea mays L., Ilex paraguariensis St. Hill., etc., y anotamos ahora recolectas sobre cultivos de perales), ya que se trata de una especie muy eurioica en la selección de hábitat y sustrato vegetal, y de amplio rango fenológico (durante todo el año) y altitudinal (10-3100 m) (Monserrat, 1996a, 2002, 2003, 2004, 2008a; Lara & Freitas, 2003). Su morfología, variabilidad y biología fue revisada por Monserrat (1996a, 1998). Los datos existentes en la península (PORTUGAL: Lisboa, Tapada da Ajuda) corresponden a imagos ex larva sobre Eucalyptus, de V-VI, a 50 m.
Sobre sus estadios preimaginales, Monserrat (2008b) describió la ultraestructura de su huevo, y sus estadios larvarios fueron descritas por Reguilón (2002), Monserrat (2003) y Lara & Freitas (2003).
Hemerobius (Hemerobius) handschini Tjeder, 1957 (Fig. 66)
Aspöck et al., 1980: 216 (rf); Monserrat, 1986a: 1208 (bio, dis); Díaz-Aranda et al., 1986a: 1125 (bio, dis), 1986b: 1137 (bio, dis); Díaz-Aranda & Monserrat, 1988b: 222 (bio, dis); Canard et al., 1992: 96 (dis); Monserrat, 1996b: 13 (list); H. Aspöck et al., 2001: 134 (rf); Monserrat & Triviño, 2013: 16 (list), 55 (dis); Monserrat, 2013: 289 (bio, dis).
Hemerobius handschini Tjeder, 1957
Ohm, 1973: 303 (rf); Monserrat, 1982: 75 (bio, dis), 1991b: 109 (dis), 1994: 19 (bio, dis); Monserrat & Marín, 1996a: 777-785 (bio), 2001: 424-431 (bio, dis); Monserrat, 2004: 5 (bio, dis); Monserrat & Triviño, 2013: 16 (list); Letardi et al., 2013: 36 (list); Monserrat et al., 2013b: 162 (bio, dis).
Nuevo material estudiado: ESPAÑA: Granada, Acebuche, 287 m, 13.IV.2014, 2♂♂, 5♀♀ sobre Pinus halepensis, 1.IX.2014, 6♂♂, 6♀♀ sobre P. halepensis. Málaga, Coín, 50 m, 1.V.2014, 4♂♂, 8♀♀ sobre P. halepensis, Frigiliana, 340 m, 2.V.2014, 6♂♂, 6♀♀ sobre P. halepensis, Maro, 2.V.2014, 4♂♂, 3♀♀ sobre P. halepensis, 1♂, 5♀♀ sobre P. halepensis.
Elemento común en el Mediterráneo septentrional, extendido a Anatolia y Corea. Recientemente se ha cuestionado molecularmente la identidad de esta especie frente a H. nitidulus (Morinière et al., 2014). Comúnmente asociado a coníferas del género Pinus. Está mayoritariamente citada entre IV-IX, en altitudes de hasta 2200 m. En nuestra fauna está mayoritariamente citada sobre coníferas, y tiene una distribución con mayor tendencia mediterránea que atlántica, y ha sido citada entre IV-X, en altitudes que oscilan entre 10-2400 m.
Hemerobius (Hemerobius) contumax Tjeder, 1932 (Fig. 64)
Aspöck et al., 1980: 213 (rf); Monserrat, 1986a: 1207 (bio, dis); Canard et al., 1992: 96 (dis); Monserrat et al., 1994: 48 (bio, dis); Monserrat, 1996b: 13 (list); H. Aspöck et al., 2001: 131 (rf); Monserrat, 2010: 24 (bio, dis); Monserrat & Triviño, 2013: 16 (list), 54 (dis).
Hemerobius contumax Tjeder, 1932
Monserrat, 1984a: 36 (bio, dis), 1986b: 104 (bio, dis), 1991b: 109 (bio, dis); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio), 2001: 424-431 (bio, dis); Monserrat, 2008a: 235 (bio, dis); Monserrat & Triviño, 2013: 16 (list); Monserrat et al., 2013a: 52 (bio, dis).
Hemerobius stigma Stephens, 1936
Navás, 1918: 41, según anota Monserrat (1986b).
A esta especie pertenece alguna cita errónea, como la dada por Navás (1918) como Hemerobius stigma Stephens, 1936, según anota Monserrat (1986b: 104). Recientemente se ha cuestionado molecularmente la identidad de esta especie respecto a H. atrifrons McLachlan, 1868 (Morinière et al., 2014).
Elemento conocido de Europa y Anatolia. Asociada a coníferas (Larix, Abies, Pinus, Picea), está mayoritariamente citada entre V-IX, en altitudes de hasta 2000 m. En nuestra fauna ha sido puntualmente citada en medios montanos extramediterráneos (Pirineos de Huesca, Lérida y Navarra) sobre abeto (Abies), entre VI-VIII, en altitudes que oscilan entre 989-1537 m.
Hemerobius (Hemerobius) perelegans Stephens, 1836 (Fig. 60)
Monserrat, 1985c: 91 (bio, dis), 1986a: 1207 (rf); H. Aspöck et al., 2001: 128 (rf); Monserrat & Triviño, 2013: 16 (list), 58 (dis).
Hemerobius perelegans Stephens, 1836
Monserrat & Marín, 1996a: 777-785 (bio), 2001: 424-431 (bio, dis); Monserrat & Triviño, 2013: 16 (list), 24 (rf); Monserrat et al., 2013a: 52 (bio, dis).
Elemento europeo extendido hasta Mongolia. Es una especie mayoritariamente citada sobre abedules y coníferas, entre V-VIII, en altitudes de hasta 2200 m. En nuestra fauna tiene una clara tendencia eurosiberiana, aunque ha sido muy escasamente citada, bien sobre Alnus, Abies o Quercus, entre VI-VIII, en altitudes que oscilan entre 120-802 m.
El huevo y la larva de esta especie fueron descritos por Killington (1934b, 1936, 1937).
Hemerobius (Hemerobius) pini Stephens, 1836 (Fig. 63)
Monserrat, 1986a: 1207 (rf); Canard et al., 1992: 96 (dis); Monserrat, 1996b: 13 (list); H. Aspöck et al., 2001: 131 (rf); Monserrat & Triviño, 2013: 16 (list), 58 (dis).
Hemerobius pini Stephens, 1836
Killington, 1937: 43 (¿rf?); Monserrat, 1984a: 35 (bio, dis); Monserrat & Marín, 1996a: 777-785 (bio), 2001: 424-431 (bio, dis); Monserrat & Triviño, 2013: 16 (list); Monserrat et al., 2013a: 52 (bio, dis).
Elemento europeo extendido a Anatolia, Siberia y Mongolia. Es una especie marcadamente asociada a coníferas (Picea, Abies, Pinus), y está mayoritariamente citada entre V-X, en altitudes de hasta 3200 m. En nuestra fauna ha sido citada en Pirineos (Navarra, Lérida), entre V-VIII, en altitudes que oscilan entre 725-1300 m.
El huevo y la larva de esta especie fueron descritos por Killington (1932g, 1936, 1937) y Gepp (1990).
Hemerobius (Hemerobius) simulans Walker, 1853 (Figs. 27, 61)
Monserrat, 1986a: 1207 (rf); Canard et al., 1992: 96 (dis); Monserrat et al., 1994: 47 (bio, dis); Monserrat, 1996b: 13 (list); H. Aspöck et al., 2001: 129 (rf); Monserrat & Triviño, 2013: 16 (list), 59 (dis).
Hemerobius simulans Walker, 1853
Killington, 1932b: 176 (¿rf?), 1937: 24 (¿rf?); Monserrat, 1984a: 35 (bio, dis), 1991b: 108 (dis), 1994: 19 (bio, dis); Monserrat & Marín, 1996a: 777-785 (bio), 2001: 424-431 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Elemento holártico conocido desde Europa a Siberia, Mongolia y Kamchatka en Asia, y de Alaska a Canadá y Estados Unidos en el norte de América. Especie asociada a coníferas, preferentemente Larix y Picea, y a planifolios como robles en medios húmedos, y está mayoritariamente citada entre III-X, en altitudes de hasta 2000 m. En nuestra fauna ha sido citada en Pirineos (Lérida, Huesca) sobre Fagus, Betula, Abies, entre VIII-IX, en altitudes que oscilan entre 1200-1620 m.
Los estadios larvarios de esta especie fueron descritos por Killington (1932b, 1936, 1937).
Wesmaelius (Kimminsia) subnebulosus (Stephens, 1836) (Figs. 10, 76, 85)
Monserrat, 1978a: 175 (bio, dis); Aspöck et al., 1980: 204 (rf); Monserrat, 1980a: 173 (bio, dis), 1980b: 185 (bio, dis), 1981: 153 (bio, dis); Campos & Ramos, 1983: 220 (bio, dis); Monserrat, 1984a: 34 (bio, dis), 1984b: 173 (bio, dis), 1984d: 98 (bio, dis), 1984e: 159 (bio, dis), 1985b: 87 (bio, dis), 1985c: 92 (bio, dis), 1986a: 1209 (bio, dis), 1986b: 104 (dis, tx); Díaz-Aranda et al., 1986a: 1125 (bio, dis), 1986b: 1138 (bio, dis); Monserrat, 1987: 136 (bio, dis); Monserrat & Díaz-Aranda, 1987: 179 (bio, dis), 1988: 90 (bio, dis), 1989: 50 (bio, dis); Díaz-Aranda & Monserrat, 1988a: 116 (bio, dis), 1988b: 221 (bio, dis), 1988c: 218 (bio, dis); Marín & Monserrat, 1989: 292 (bio, dis), 1990: 224 (bio, dis), 1991a: 181 (bio, dis); Canard et al., 1992: 97 (dis); Monserrat et al., 1994: 46 (bio, dis); Marín & Monserrat, 1995a: 114 (bio, dis), 1995b: 40 (bio, dis); Monserrat, 1996b: 13 (list); H. Aspöck et al., 2001: 143 (rf); Monserrat, 2005: 75 (bio, dis); Monserrat & Triviño, 2013: 16 (list), 71 (dis); Monserrat, 2013: 290 (rf).
Boriomyia subnebulosa (Stephens, 1836)
Navás, 1908: 120 (dis, mf), 1909b: 376 (dis); Andréu, 1911: 58 (dis); Navás, 1911: 208 (dis), 1913a: 82 (dis), 1913b: 76 (dis), 1914a: 40 (dis), 1914b: 34 (dis), 1914c: 212 (dis), 1914d: 188 (dis), 1915a: 50 (dis), 1916a: 172 (dis); Bohigas & Sanchez, 1917: 316 (dis); Esben-Petersen, 1931: 3 (dis); Ohm, 1967: 243 (dis); Laffranque & Canard, 1975: 332 (rf); Canard et al., 1979: 611 (rf); Séméria & Berland, 1988: 154 (rf); Monserrat & Triviño, 2013: 16 (list).
Hemerobius subnebulosus Stephens, 1836
McLachlan, 1880: 107 (dis), 1899: 79 (dis), 1902b: 33 (dis); Navás, 1904a: 127 (dis), 1905a: 506 (dis), 1905c: 35 (dis, mf); King & Halbert, 1910: 75 (rf); Navás, 1916d: 154 (dis), 1917b: 87 (dis), 1918: 41 (dis), 1919a: 194 (dis), 1919c: 42 (dis), 1922b: 109 (dis), 1924a: 108 (rf), 1924b: 200 (key), 202 (dis, mf), 1924c: 129 (dis), 1924d: 25 (dis), 1925a: 97 (key), 99 (mf, rf), 1927b: 123 (dis), 1927c: 113 (dis, tx), 1931a: 120 (dis); Vidal y López, 1943: 23 (dis); Monserrat & Triviño, 2013: 16 (list).
Hemerobius subnebulosus lucida Navás, 1919
Navás, 1919d: 222 (d), 1924b: 202 (dis, mf), 1925a: 100 (dis, mf); Monserrat, 1985a: 240 (tx); Monserrat & Triviño, 2013: 16 (list).
Hemerobius subnebulosus obscura Navás, 1917
Navás, 1916d: 154 (dis), 1917a: 164 (dis), 1922a: 193 (dis), 1924b: 203 (dis, mf), 1925a: 99 (dis, mf); Monserrat, 1985a: 240 (tx); Monserrat & Triviño, 2013: 16 (list).
Kimminsia subnebulosa (Stephens, 1836)
Monserrat, 1977: 18 (list), 86 (key), 88 (bio, dis), 1979a: 411 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Kimminsia subnebulosa lucida Navás, 1919
Monserrat, 1977: 90 (list); Monserrat & Triviño, 2013: 16 (list).
Mucropalpus distinctus Rambur, 1842
Rambur, 1842: 421 (d); Costa, 1855: 10 (rf); Rosenhauer, 1856: 367 (rf); Pictet, 1865: 56 (dis, tx); Monserrat, 1986a: 1208 (rf), 1991b: 104 (rf), 105 (tx); Klimaszewski & Kevan, 1987a: 169 (rf); Monserrat & Triviño, 2013: 16 (list).
Hemerobius distinctus (Rambur, 1842)
Walker, 1853: 295 (rf).
Wesmaelius subnebulosus (Stephens, 1836)
Monserrat, 1982: 75 (bio, dis), 1983a: 209 (rf); 1986a: 1208, 1209 (rf), Marín & Monserrat, 1987: 350-359 (bio, dis); Monserrat, 1990b: 87 (bio, dis), 1991b: 104 (rf), 105 (bio, dis, tx); Marín & Monserrat, 1991b: 192 (bio, dis); Monserrat, 1994: 12 (bio, dis); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio); Monserrat et al., 1999: 38 (rf), 41 (rf), 42 (bio, dis); Monserrat & Marín, 2001: 424-431 (bio, dis); Monserrat, 2004: 8 (bio, dis), 2008a: 237 (bio, dis); Ocharan et al., 2012: 424 (bio, dis); Monserrat & Triviño, 2013: 16 (list); Letardi et al., 2013: 36 (list); Monserrat et al., 2013a: 52 (bio, dis), 2013b: 162 (bio, dis).
Nuevo material estudiado: ESPAÑA: Granada, Acebuche, 287 m, 13.IV.2014, 2♂♂, 2♀♀ sobre Pinus halepensis, 1.IX.2014, 6♂♂, 3♀♀ sobre P. halepensis, La Herradura, Punta de la Mona, 30SVF36, 200 m, 5.IV.2015, 1♂ a la luz, 13.IV.2015, 1♀ a la luz, 17.IV.2015, 1♂ a la luz, 4.V.2015, 2♂♂ a la luz, Presa de Rules 280 m, 13.IV.2014, 2♂♂, 3♀♀ sobre P. halepensis, 18.VII.2014, 5♂♂, 3♀♀ sobre P. halepensis, 1.IX.2014, 2♂♂, 2♀♀ sobre P. halepensis, Vélez de Benaudalla, 350 m, 13.IV.2014, 1♂, 2♀♀ sobre Olea europaea, 18.VII.2014, 6♂♂, 3♀♀ sobre P. halepensis, 1.IX. 2014, 1♂, 2♀♀ sobre P. halepensis. Madrid, Rivas Vaciamadrid, 15.VI.2013, 1♂, J.I.L. Colón, San Fernando de Henares, 27.V.2012, 1♀, J.I.L. Colón (Fig. 12). Málaga, Coín, 50 m, 1.V.2014, 6♂♂, 3♀♀ sobre O. europea, Frigiliana, 340 m, 2.V.2014, 6♂♂, 3♀♀ sobre O. europea, Maro, 2.V.2014, 2♂♂, 3♀♀ sobre O. europea, 1♂, 3♀♀ sobre P. halepensis, Pinos de Alhaurín, 220 m, 2.V.2014, 2♂♂, 3♀♀ sobre P. halepensis. Tarragona, La Selva del Camp, 41°13′0767″N 1°08′3694″E, 224 m, 20.I.2007, 1♂, 16.XI.2007, 1♀, 14.XII.2007, 1♂, 15.I.2008, 1♀, 12.II.2008, 1♀, 14.V.2008, 1♀, 15.V.2008, 1♀, 16.VI.2008, 1♀, 7.III.2011, 1♀, todos sobre Citrus clementina, N. Cañellas. Zaragoza, Bagués, La Parueta, Vallatanso, 30TXN7212, 760 m, 26.VI.2014, 1♀ sobre Quercus faginea, S. Pagola.
Especie holártica, probablemente es introducida en Norte América, y sin duda en Nueva Zelanda (Wise, 1973; Monserrat, 1994, 1998). Significativamente eurioica y citada sobre multitud de sustratos vegetales diferentes. Está mayoritariamente citada entre III-XI, en altitudes de hasta 2030 m. En nuestra fauna posee una muy amplia distribución, y ha sido citada sobre muy diversos sustratos vegetales, mayoritariamente entre V-IX, aunque en zonas costeras posee actividad en los meses de invierno, tanto machos como hembras, y ha sido recolectada en altitudes que oscilan entre 10-2100 m.
El huevo y la larva de esta especie fueron descritos por Withycombe (1923), Killington (1936, 1937), Frankenberg (1937) y Laffranque & Canard (1975).
Wesmaelius (Kimminsia) navasi (Andréu, 1911) (Figs. 16-18, 28, 72, 86)
Monserrat, 1979b: 21 (bio, dis); Aspöck et al., 1980: 11 (dis), 206 (rf); Monserrat, 1980a: 173 (dis), 1983a: 209-222 (bio, dis, h, l, mf, p), 1984d: 112 (rf), 1985b: 87 (bio, dis), 1986a: 1211 (bio, dis), 1987: 136 (bio, dis); Díaz-Aranda & Monserrat, 1988c: 219 (rf); Monserrat & Díaz-Aranda, 1988: 90 (bio, dis), 1989: 50 (bio, dis); Marín & Monserrat, 1991a: 181 (rf), 1995a: 114 (dis), 1995b: 38 (rf); Monserrat, 1996b: 13 (list); H. Aspöck et al., 2001: 144 (rf); Monserrat, 2005: 75 (rf); Monserrat & Triviño, 2013: 16 (list), 69 (dis); Monserrat, 2013: 290 (rf).
Boriomyia navasi Andréu, 1911
Andréu, 1911: 58 (d); Navás, 1912: 531 (dis), 1915d: 128 (dis, mf), 1915a: 68 (dis); Zacwilichowski, 1938a: 244 (dis), 1938b: 38 (dis); Meinander, 1965: 60 (rf); Ohm, 1967: 234 (rf), 237 (dis, mf); Monserrat, 1985a: 240 (tx); Monserrat & Triviño, 2013: 16 (list).
Boriomya navasi Andréu, 1911 (lapsus)
Monserrat, 1978c: 62 (bio, dis).
Hemerobius navasi (Andréu, 1911)
Navás, 1916d: 154 (dis), 1924a: 108 (rf), 1924b: 200 (key), 204 (dis, mf), 1925a: 97 (key), 100 (dis, mf); Vidal y López, 1943: 23 (dis); Monserrat & Triviño, 2013: 16 (list).
Wesmaelius navasi (Andréu, 1911)
Monserrat, 1983b: 126 (rf), 1986a: 1208 (rf), 1990b: 87 (bio, dis), 1991b: 104 (rf), 106 (dis), 1994: 14 (bio, dis); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio); Monserrat & Deretsky, 1999: 48 (bio, dis); Monserrat & Marín, 2001: 424-431 (bio, dis); Monserrat, 2004: 9 (bio, dis), 2008a: 239 (bio, dis, tx); Monserrat & Triviño, 2013: 16 (list); Monserrat et al., 2013b: 162 (bio, dis).
A esta especie debe asignarse el material de Tenerife que cita Navás (1906: 701) como Boriomyia nervosa Fabricius, 1793, según menciona Monserrat (2008a). También a esta especie deben pertenecer algunas citas meridionales y litorales que se comentan en otras especies de este género, y también dudamos de la correcta identificación de esta especie en Lérida (Navás, 1916d). Las citas de Sierra Nevada a 1500 m (Aspöck et al., 1980) y 2000-3200 m (Monserrat, 1991b) muy probablemente pertenecen a W. ravus, especie recientemente registrada a estas altitudes en esta zona.
Especie eremial conocida del límite meridional de la Región Paleártica occidental, desde Madeira y Canarias, sur de Europa, Marruecos y Argelia a Afganistán, Pakistán, Irán y Mongolia. Mayoritariamente recolectada a la luz, es de biología muy poco conocida (casi siempre recolectada a la luz), y está marcadamente asociada a medios térmicos y xéricos, también en la península, donde posee una clara tendencia mediterránea y se distribuye por su cuadrante sud-oriental. A veces se ha citado sobre plantas cultivadas (naranjos, albaricoques, olivos), también sobre Quercus, Ceratonia y Tamarix (Andréu, 1911; Monserrat, 1979b, 1987; Şengonca, 1979; Monserrat & Díaz-Aranda, 1988, 1989). En la bibliografía W. navasi ha sido citada a lo largo de todo el año (salvo agosto) y desde 10 m hasta 1200 m en diferentes zonas ibéricas, macaronésicas y norteafricanas. En la península, y en los meses más fríos, ha sido recolectada en enero y diciembre en Cádiz, Almería y Murcia (Monserrat, 1983a, 1986a, 1990b, 1991b; Monserrat et al., 2013b). Posee pues actividad de los imagos a lo largo de todo el año, al menos en el sur de España. Probablemente esté asociada a vegetación baja (Monserrat, 1994 la cita bajo gramíneas en Almería) y con frecuencia ha sido recolectada en medios marcadamente antrópicos.
La morfología de su huevo y sus estadios larvarios fueron descritos por Monserrat (1983a).
Wesmaelius (Kimminsia) ravus (Withycombe, 1923) (Figs. 71, 87)
Aspöck et al., 1980: 205 (rf); Monserrat, 1986a: 1212 (rf); H. Aspöck et al., 2001: 144 (rf); Monserrat, 2005: 76 (rf, tx); Monserrat & Triviño, 2013: 16 (list), 70 (dis).
Wesmaelius (Kimminsia) rava (Withycombe, 1923)
Monserrat & Triviño, 2013: 16 (list).
Kimminsia rava (Withycombe, 1923)
Monserrat, 1977: 18 (list), 85 (key), 87 (bio, dis, rf), 1978b: 177 (bio, dis, mf); Monserrat & Triviño, 2013: 16 (list).
Wesmaelius ravus (Withycombe, 1923)
Monserrat & Marín, 1996a: 777-785 (bio), 2001: 424-431 (bio, dis); Monserrat & Triviño, 2013: 24 (rf); Monserrat et al., 2013b: 162 (bio, dis).
A Wesmaelius (Kimminsia) navasi habría que asignar, con toda probabilidad, la referencia en Baleares de W. ravus de Aspöck et al. (1980, quizás derivada de anteriores citas), y siempre nos han parecido muy cuestionables las “citas” dadas por estos autores en las zonas litorales de Galicia y Cataluña en el mapa de la ditribución general de W. ravus (Aspöck et al., 1980: 295), citas que refiere Monserrat (1986a) y que fueron posteriormente comentadas por Monserrat (2005) y Monserrat et al. (2013b), y que sin duda habría que adjudicarlas a otras especies de este género. Alguna de estas citas se comentarán al hablar de Wesmaelius (Kimminsia) nervosus.
Especie holártica de distribución fragmentaria postglacial, citada en zonas elevadas (hasta 2400 m), desde Europa y Anatolia al Cáucaso y Japón. Aparentemente asociada a coníferas de alta montaña, especialmente a Pinus, donde parece habitar en las ramas más elevadas. Está mayoritariamente citada entre V-IX. En nuestra fauna esta escasa, enigmática y orófila especie fue citada en la Península Ibérica (Sierra de Guadarrama, Madrid, a 1500 y 2100 m y Sierra Nevada (Granada, 2050 m) sobre P. sylvestris (Monserrat, 1977, 1978b; Monserrat et al., 2013b). Conocida su presencia en Sierra Nevada, es muy probable que pertenezcan a esta especie los ejemplares del BMNH citados en esta zona por Monserrat (1991b) como W. navasi. Está citada entre VI-VII.
Algunos datos sobre los estadios larvarios de esta especie fueron comentados por Killington (1937).
Wesmaelius (Kimminsia) fassnidgei (Killington, 1933) (Figs. 68, 81)
Aspöck et al., 1980: 200 (rf); Monserrat, 1986a: 1212 (rf); Canard et al., 1992: 97 (dis?); H. Aspöck et al., 2001: 140 (rf); Monserrat & Triviño, 2013: 16 (list), 72 (dis).
Wesmaelius fassnidgei (Killington, 1933)
Popov, 1996: 210 (rf), 211 (rf); Monserrat & Marín, 1996a: 777-785 (bio); Monserrat & Triviño, 2013: 16 (list), 24 (rf), 25 (rf).
Citada del Pirineo oriental (Andorra, Francia) por Ohm (1967) y Aspöck et al. (1980), citas comentadas por Monserrat (1986a, 1986b) y que fueron dudosamente incluidas en la zona ibérica de Pirineos por Canard et al. (1992). Consideramos que su presencia en nuestra fauna debería mantenerse a la espera, hasta que nuevos datos confirmen su presencia en la zona de estudio, y no se trate, en realidad, de Wesmaelius quadrifasciatus.
Especie europea extramediterránea. Está mayoritariamente citada sobre coníferas, especialmente Larix, Picea y Pinus (aunque ha sido mayoritariamente recolectada a la luz), entre V-X, en altitudes de 700 hasta 2100 m. En la fauna ibérica (Andorra) ha sido citada en VII, en altitud de 2100 m.
Wesmaelius (Kimminsia) helveticus (Aspöck & Aspöck, 1964) (Figs. 74, 78)
H. Aspöck et al., 2001: 141 (rf); Monserrat & Triviño, 2013: 16 (list), 68 (dis).
Wesmaelius helveticus (Aspöck & Aspöck, 1964)
Monserrat, 1994: 15 (dis), 17 (mf); Monserrat & Marín, 1996a: 777-785 (bio), 2001: 424-431 (bio, dis); Monserrat & Triviño, 2013: 16 (list), 24 (rf).
Especie centroeuropea extramediterránea de carácter postglaciar, extendida hasta Anatolia, Armenia e Irán. Está mayoritariamente citada sobre coníferas y vegetación de alta montaña, entre VII-IX, en altitudes de hasta 2000 m. En nuestra fauna ha sido puntualmente citada en la Sierra de Guadarrama (trampa de Malaise en un pinar de Pinus sylvestris) en VIII, a 1480 m.
Wesmaelius (Kimminsia) malladai (Navás, 1925) (Figs. 73, 84)
Gepp, 1977: 186 (¿rf?); Monserrat, 1984a: 34 (bio, dis), 1986a: 1212 (rf); Canard et al., 1992: 97 (dis); Monserrat, 1996b: 13 (list); H. Aspöck et al., 2001: 142 (rf); Monserrat & Triviño, 2013: 16 (list), 69 (dis).
Wesmaelius malladai (Navás, 1925)
Monserrat & Marín, 1996a: 777-785 (bio), 2001: 424-431 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Especie europea extendida hasta Anatolia y Cáucaso. Está mayoritariamente citada sobre coníferas, especialmente Pinus, también sobre enebros, robles, chopos, álamos y otros planifolios, entre V-X, en altitudes de hasta 2500 m. En nuestra fauna ha sido puntualmente citada en Pirineos (Huesca) sobre robles, en VIII, en altitudes que oscilan entre 1200-1390 m.
Wesmaelius (Kimminsia) nervosus (Fabricius, 1793) (Figs. 75, 82)
Monserrat, 1984a: 46 (rf, tx), 1986a: 1208 (bio, dis, tx); Aspöck et al., 1980: 201 (rf); Díaz-Aranda & Monserrat, 1988c: 218 (rf); Canard et al., 1992: 97 (dis); Monserrat, 1996b: 13 (list); H. Aspöck et al., 2001: 141 (rf); Monserrat, 2005: 75 (rf, tx), 2010: 25 (bio, dis); Monserrat & Triviño, 2013: 16 (list), 70 (dis); Monserrat, 2013: 305 (rf).
Boriomyia betulina (Strøm, 1788)
Mosely, 1932a: 282 (dis); Killington, 1934b: 123 (rf), 1937: 89 (rf); Hölzel, 1964: 131 (rf); Monserrat, 1991b: 106 (tx); Monserrat & Triviño, 2013: 16 (list).
Boriomyia (Kimminsia) betulina (Strøm, 1788)
Zelený, 1963: 63 (rf); Monserrat & Triviño, 2013: 16 (list).
Hemerobius betulinus Strøm, 1788
Navás, 1927c: 113 (dis), 1929b: 32 (dis), 1929c: 40 (dis); Monserrat, 1986b: 104 (rf, tx), 1991b: 106 (rf, tx); Monserrat & Triviño, 2013: 16 (list).
Hemerobius nervosus Fabricius, 1793
Pictet, 1865: 56, 108 (dis, mf, tx); Hagen, 1866c: 297 (dis, rf); Bolívar, 1878: 63 (dis); Monserrat, 1977: 18 (list), 87 (rf), 1991b: 104 (rf); Monserrat & Triviño, 2013: 16 (list).
Kimminsia betulina (Strøm, 1788)
Nakahara, 1960a: 52 (rf); Monserrat, 1977: 18 (list), 86 (key), 87 (rf); Monserrat & Triviño, 2013: 16 (list).
Wesmaelius nervosus (Fabricius, 1793)
Monserrat, 1986a: 1208 (rf), 1991b: 104 (dis, tx), 1994: 12 (bio, dis), 17 (mf); Monserrat & Marín, 1996a: 777-785 (bio), 2001: 424-431 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Por sus requerimientos ambientales (marcadamente eurosiberiana y extratérmica), muchas de las citas antiguas existentes de esta especie (o sus sinonimias) en nuestra región, bien en la Península y/o en Baleares, incluso Canarias, resultaban dudosas o muy cuestionables, especialmente las dadas fuera de su región eurosiberiana. Las citas de Pictet (1865), Hagen (1866c) y Bolívar (1878) de Navacerrada y San Ildefonso son dudosas, en especial porque mayoritariamente consideraban que Mucropalpus distinctus Rambur, 1842 [= Wesmaelius subnebulosus (Stephens, 1836)] era sinónima de la especie que tratamos, y la de Granada es muy cuestionable, citas comentadas por Monserrat (1977, 1986a, 1991b, 2013) y Díaz-Aranda & Monserrat (1988c), anotando su confusión o posible confusión con W. subnebulosus o W. navasi, especies mucho más térmicas y xerófilas (ver comentarios en W. subnebulosus y W. navasi). Igual ocurre con las citas de Navás (1906, 1927c, 1929c) de Canarias, Baleares y Tarragona, que sin duda eran erróneas y fueron comentadas por Monserrat (1986a, 1991b, 2008a, 2005, 2010) y existen pocas dudas que pertenezcan a alguna de las dos especies anteriormente mencionadas (con mayor probabilidad W. navasi, y así lo demuestra Monserrat, 2008a con ejemplares de Canarias), y curiosamente Navás (1927c) la considera sinónima a W. subnebulosus, según reseña Monserrat (1984a), por lo que sus citas no deberían considerarse, y de hecho Monserrat (1986b) asigna a W. subnebulosus algún ejemplar identificado por Navás como Hemerobius betulinus Strøm, 1788. Todas estas citas quedan mayoritariamente reflejadas en Monserrat & Triviño (2013). Aún así, quizá pueda ser “acertada” alguna de las citas del Pirineo Catalán y Aragonés que bajo esta última denominación (Hemerobius betulinus) menciona este autor (Navás, 1927c, 1929b). Lo mismo ocurre con el material de Tenerife que cita Navás (1906) como Boriomyia nervosa Fabricius, 1793, que según Monserrat (2008a) ha de asignarse a Wesmaelius navasi. Igual ocurre con la referencia en Baleares de W. ravus (quizás derivada de estas anteriores citas) de Aspöck et al. (1980), que fue comentada por Monserrat (2005) y que sin duda habría que adjudicarla a esta última especie que citamos. La única cita más fiable de esta especie fue dada por Mosely (1932a: 282) de Panticosa (Huesca), probable origen (si no las anteriores citas mencionadas) de todas las posteriores referencias de esta especie en la fauna ibérica (Killington, 1934b, 1937; Nakahara, 1960a; Zelený, 1963; Hölzel, 1964). En base a este material, esta cita fue parcialmente descartada y adjudicada a W. subnebulosus, y parte resultó correcta (Monserrat, 1991b: 105). También conviene mencionar que Killington (1937: 80) comenta que la descripción que hace Navás (1923) de la genitalia del macho de Wesmaelius navasi (como Hemerobius navasi) (reiterado en Navás, 1924a, 1925a), según él, pertenece a Wesmaelius nervosus (citada como Boriomyia betulina). Se trata de una errónea interpretación del “particular” dibujo de Navás de un ejemplar de Orihuela (Alicante), que sin duda pertenece a la especie Wesmaelius navasi, esta reseña ha podido generar posteriores referencias erróneas de Wesmaelius nervosus en nuestra fauna. También fuera de nuestra fauna, similares errores y sinonimias en relación con esta especie fueron comentedas en especies americanas por Carpenter (1940), Nakahara (1960a), Klimaszewski & Kevan (1987a, 1987b) o Monserrat (1998). Por lo tanto, las únicas citas correctas de esta especie en la zona estudiada se limitan a la región eurosiberiana (Ancares en Lugo, Asturias y Pirineos de Huesca y Andorra) (Monserrat, 1986a, 1991b, 1994, 2010).
Especie holártica extramediterránea conocida desde el centro y norte de Europa y Groenlandia a Pakistán, Corea, Kamchatka, Alaska, Canadá y Estados Unidos. Aunque parece ser una especie eurioica, está mayoritariamente citada sobre coníferas, especialmente Pinus y Picea, también se ha citado en bosques húmedos de caducifolios con hortigas, sauces y abedules, entre IV-X, en altitudes de hasta 2400 m. Aunque en ocasiones ha sido erróneamente citada en nuestra fauna, según hemos comentado, las citas fiables lo han sido sobre Abies y Corylus, entre VII-IX, en altitudes que oscilan entre 1000-2400 m.
El huevo y la larva de esta especie fueron descritos por Withycombe (1923), Miles (1924), Killington (1934b, 1936, 1937), como Boriomyia betulina y por Morton (1935).
Wesmaelius (Kimminsia) reisseri Aspöck & Aspöck, 1982 (Figs. 77, 83)
Aspöck & Aspöck, 1982: 289 (d); Popov, 1986b: 324 (dis, rf); Monserrat, 1986a: 1212 (rf, tx); H. Aspöck et al., 2001: 140 (rf); Monserrat & Triviño, 2013: 16 (list), 71 (dis).
Wesmaelius reisseri Aspöck & Aspöck, 1982
Monserrat, 1991b: 106 (dis), 1994: 17 (dis, mf); Monserrat & Marín, 1996a: 777-785 (bio), 2001: 424-431 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Wesmaelius reiseri Aspöck & Aspöck, 1982 (lapsus)
Popov, 1996: 210 (rf), 212 (rf); Monserrat & Triviño, 2013: 24 (rf). Kimminsia sp.
Monserrat, 1977: 87 (bio, dis), 1986a: 1212 (rf, tx).
Esta especie fue citada como Kimminsia sp. por Monserrat (1977: 87).
Especie endémica del Sistema Central ibérico (Sierras de Gredos y Guadarrama). Su biología es desconocida, habiéndose recolectado sobre Pinus sylvestris. Ha sido citada en VII, en altitudes que oscilan entre 1860-2350 m.
Wesmaelius (Wesmaelius) concinnus (Stephens, 1836) (Figs. 69, 79)
Monserrat, 1986a: 1217 (rf, tx); Monserrat & Triviño, 2013: 16 (list), 72 (dis).
Wesmaelius concinnus (Stephens, 1836)
Killington, 1937: 104 (rf); Monserrat, 1994: 13 (rf, tx); Monserrat & Marín, 1996a: 777-785 (bio); Monserrat & Triviño, 2013: 25 (rf).
Boriomyia (Wesmaelius) concinna (Stephens, 1836)
Zelený, 1963: 64 (rf); Monserrat & Triviño, 2013: 16 (list).
Hemerobius concinnus Stephens, 1836
Navás, 1916d: 154 (dis), 1924a: 108 (rf), 1924b: 200 (key), 201 (dis, mf), 1925a: 99 (dis, mf); Monserrat & Triviño, 2013: 16 (list).
Sigue sin confirmarse la posible cita de esta especie en San Juan de Erm, Lérida (Navás, 1916d, 1925a), según anotan Monserrat (1986a), Monserrat et al. (1994) y Monserrat & Triviño (2013). Desde luego el dibujo que Navás (1924b, 1925a) realiza de la genitalia masculina de este ejemplar parece pertenecer a la especie que tratamos, pero no puede descartarse que se trate de Wesmaelius quadrifasciatus (Reuter, 1894), especie conocida en la zona, aunque recientemente se ha cuestionado molecularmente la identidad diferente de ambas especies (Morinière et al., 2014). Quizás estas referencias hayan generado las de Killington (1937) y Zelený (1963). No obstante Aspöck et al. (1980) y H. Aspöck et al. (2001) no la recogen de España o de Portugal. Seguimos a la espera de que nuevos ejemplares confirmen o descarten su presencia en la zona estudiada.
Especie centro-noreuropea extra-mediterránea (ausente en las penínsulas mediterráneas) de origen postglaciar, extendida a Anatolia, Mongolia, Siberia y Corea. Se ha citado mayoritariamente sobre coníferas, especialmente Pinus y Picea, también sobre alerces, sauces, etc., entre V-IX, hasta 2100 m.
El huevo y la larva de esta especie fueron descritos por Withycombe (1923, 1925) y Killington (1937).
Wesmaelius (Wesmaelius) quadrifasciatus (Reuter, 1894) (Figs. 12, 13, 23, 30, 70, 80)
Aspöck et al., 1980: 199 (rf); Monserrat, 1986a: 1208 (rf); Canard et al., 1992: 97 (dis); Monserrat, 1996b: 13 (list); H. Aspöck et al., 2001: 139 (rf); Monserrat & Triviño, 2013: 16 (list), 72 (dis).
Wesmaelius quadrifasciatus (Reuter, 1894)
Killington, 1937: 110 (¿rf?); Monserrat, 1994: 13 (rf), 14 (bio, dis); Monserrat & Marín, 1996a: 777-785 (bio), 2001: 424-431 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Especie europea de distribución postglaciar fragmentada, extendida a Anatolia y Siberia. Como hemos indicado, recientemente se ha cuestionado molecularmente la identidad de esta especie y la anteriormente citada (Morinière et al., 2014). Está mayoritariamente citada sobre coníferas, especialmente Abies, Picea, Pinus y Larix, entre V-X, su caracter orófilo hace que se haya citado en altitudes de hasta 3000 m. En nuestra fauna ha sido citada en el Pirineo (Lérida, Huesca) sobre Abies en VIII, en altitudes que oscilan entre 1245-1340 m.
El huevo y la larva de esta especie fueron descritos por Withycombe (1923), Killington (1934b, 1936, 1937) y Gepp (1999).
Sympherobiinae Comstock, 1918
La división de varios subgéneros dentro del género Sympherobius (Sympherobius Banks, 1904, Niremberge Navás, 1909, Lachlanius Krüger, 1922, Eurobius Krüger, 1922) en base a elementos de la venación alar no tiene correspondencia con las estructuras genitales, y por ello no han sido considerados. Por otra parte el empleo de Nieremberge, en vez de Niremberge está bastante extendido en la bibliografía (ver referencias en las especies citadas).
Sympherobius elegans (Stephens, 1836) (Figs. 96, 105)
Navás, 1908: 121 (key), 122 (dis), 1911: 209 (mf); Andréu, 1911: 59 (dis); Navás, 1913a: 82 (dis), 1914a: 40 (dis), 1915a: 68 (dis), 1916d: 154 (dis); Bohigas & Sanchez, 1917: 316 (dis); Navás, 1919a: 194 (dis), 1921a: 65 (dis), 1921b: 151 (dis), 1922b: 109 (dis), 1923: 8 (dis), 1924b: 191 (key), 192 (dis, mf), 1925a: 92 (dis, key, mf), 1931a: 120 (dis); Killington, 1937: 116 (rf); Vidal y López, 1943: 22 (dis); Monserrat, 1977: 19 list, 77 (key), 83 (bio, dis), 1978c: 61 (bio, dis), 1979a: 412 (bio, dis); Marín & Monserrat, 1987: 350-359 (bio, dis); Monserrat, 1990b: 78 (bio, dis), 1991b: 109 (bio, dis), 1994: 21 (bio, dis); Marín, 1994: 254-302 (bio, dis); Monserrat et al., 1994: 48 (bio, dis); Marín & Monserrat, 1995a: 115 (bio, dis), 1995b: 38 (rf); Monserrat, 1996b: 13 (list); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio), 2001: 424-431 (bio, dis); Monserrat, 2004: 10 (bio, dis), 2008a: 239 (bio, dis); Monserrat & Triviño, 2013: 16 (list), 64 (dis); Letardi et al., 2013: 36 (list); Monserrat et al., 2013a: 53 (bio, dis), 2013b: 163 (bio, dis); Monserrat, 2013: 290 (rf).
Hemerobius elegans Stephens, 1836
Navás, 1905c: 35 (dis, mf); Monserrat, 1977: 84 (rf); Monserrat & Triviño, 2013: 16 (list).
Nephasitus catalaunicus Navás, 1930 (sic)
Navás, 1930b: 161 (d), 1931b: 238 (dis), Oswald, 1988a: 448 (list, rf); Monserrat & Triviño, 2013: 16 (list).
Symphaerobius elegans (Stephens, 1836) (sic)
Nagler, 1958: 302 (rf).
Sympherobius elegans striatella Klapalek, 1905
Navás, 1924b: 193 (dis, mf), 1925a: 92 (dis, mf), 1928b: 99 (dis), 1929d: 124 (dis), 1930a: 51 (dis); Monserrat & Triviño, 2013: 16 (list).
Sympherobius striatellus Klapalek, 1905
Navás, 1916c: 188 (dis, tx); Bohigas & Sanchez, 1917: 316 (dis); Navás, 1918: 41 (dis); Monserrat & Triviño, 2013: 16 (list).
Sympherobius vicentei Navás, 1914
Navás, 1914b: 34 (d), 1916c: 188 (tx), 189 (tx); Monserrat & Triviño, 2013: 16 (list).
Sympherobius (Sympherobius) elegans (Stephens, 1836)
Monserrat, 1978a: 175 (bio, dis); 1980a: 173 (bio, dis), 1980b: 185 (bio, dis); Aspöck et al., 1980: 229 (rf); Monserrat, 1984a: 46 (rf), 1984d: 97 (bio, dis), 1984e: 159 (bio, dis), 1985b: 88 (bio, dis), 1986a: 1214 (bio, dis), 1987: 136 (bio, dis); Díaz-Aranda et al., 1986a: 1125 (bio, dis), 1986b: 1137 (bio, dis); Monserrat & Díaz-Aranda, 1987: 179 (bio, dis), 1988: 90 (bio, dis); Díaz-Aranda & Monserrat, 1988a: 117 (bio, dis), 1988b: 221 (bio, dis), 1988c: 219 (bio, dis); Monserrat & Díaz-Aranda, 1989: 51 (bio, dis); Marín & Monserrat, 1989: 292 (dis), 1990: 224 (bio, dis), 1991a: 181 (bio, dis); Canard et al., 1992: 97 (dis); H. Aspöck et al., 2001: 149 (rf); Monserrat & Triviño, 2013: 16 (list).
Sobre algunas citas de L. Navás de esta especie conviene mencionar que, en ocasiones, parece considerarla sinónima de Sympherobius pygmaeus (Rambur, 1842), y así en Navás (1905c: 35) refiere: Sympherobius elegans (Stephens, 1836) (pigmaeus) (sic). Por la enorme variabilidad en tamaño y pigmentación que presentan los ejemplares de esta especie, también tenemos ciertas dudas sobre la incuestionable diagnosis de esta especie y su validez en relación a S. pygmaeus, tal como mencionamos más adelante al tratar esta especie.
Especie ampliamente distribuida en Europa y extendida hasta Anatolia y Kazajstán. Aparentemente eurioica, y muy variable en su tamaño y pigmentación. Está mayoritariamente citada entre V-XI, en altitudes de hasta 1800 m. En nuestra fauna posee una amplia distribución, y ha sido citada entre II-X, en altitudes que oscilan entre 10-2050 m.
El huevo y la larva de esta especie fueron descritos por Withycombe (1923) y comentados por Killington (1937).
Sympherobius pygmaeus (Rambur, 1842) (Figs. 95, 106)
Navás, 1925a: 92 (dis, key, mf); Killington, 1937: 122 (rf); Monserrat, 1977: 19 (list), 77 (key), 79 (bio, dis), 1979a: 411 (bio, dis); Marín & Monserrat, 1987: 350-359 (bio, dis); Monserrat, 1982: 75 (bio, dis), 1990b: 78 (bio, dis), 1991b: 110 (bio, dis), 1994: 21 (bio, dis); Monserrat et al., 1994: 48 (bio, dis); Marín & Monserrat, 1995a: 115 (bio, dis), 1995b: 40 (bio, dis); Monserrat, 1996b: 13 (list); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio); Monserrat et al., 1999: 38 (rf), 42 (bio, dis); Monserrat & Marín, 2001: 424-431 (bio, dis); Whittington, 2002: 380 (rf); Monserrat, 2004: 10 (bio, dis), 2005: 76 (rf), 2008a: 239 (bio, dis), 2011: 173 (bio, dis, tx), 174 (bio, dis, tx); Ocharan et al., 2012: 424 (rf); Monserrat & Triviño, 2013: 16 (list), 67 (dis); ); Letardi et al., 2013: 36 (list); Monserrat et al., 2013a: 53 (bio, dis), 2013b: 163 (bio, dis); Monserrat, 2013: 290 (rf).
Hemerobius pygmaeus (Rambur, 1842)
Pictet, 1865: 56 (dis, mf), 108 (dis); Hagen, 1866c: 297 (dis, rf); Monserrat & Triviño, 2013: 16 (list).
Hemerobius elegans pygmaeus Rambur, 1842
Monserrat & Triviño, 2013: 16 (list).
Sympherobius gratiosus Navás, 1908
Navás, 1908: 121 (key), 122 (d), 1911: 209 (mf), 1913a: 82 (dis); Codina, 1913: 98 (dis); Navás, 1917b: 87 (dis), 1917c: 40 (dis); Bohigas & Sanchez, 1917: 316 (dis); Navás, 1919a: 194 (dis), 1919c: 42 (dis), 1924b: 191 (key), 194 (dis, mf), 1925a: 92 (key), 94 (dis, mf), 1928a: 45 (dis), 1930a: 51 (dis), 1932: 15 (dis); Monserrat, 1977: 19 (list), 76 (key), 77 (dis); 1986a: 1218 (bio, rf, tx), 1994: 23 (bio, dis); Marín, 1994: 254-302 (bio, dis); Marín & Monserrat, 1995a: 115 (bio, dis); Monserrat, 1996b: 13 (list); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio); Monserrat et al., 1999: 38 (rf), 42 (bio, dis); Monserrat & Marín, 2001: 424-431 (bio, dis); Monserrat, 2004: 11 (bio, dis), 2005: 76 (rf), 2008a: 242 (bio, dis), 2011: 172 (tx); Monserrat & Triviño, 2013: 16 (list); Letardi et al., 2013: 36 (list).
Sympherobius (Sympherobius) gratiosus Navás, 1908
Monserrat, 1980b: 185 (bio, dis); H. Aspöck et al., 2001: 149 (rf); Monserrat & Triviño, 2013: 16 (list).
Sympherobius bellus Navás, 1911
Navás, 1911: 208 (d); Monserrat, 2011: 173 (tx); Monserrat & Triviño, 2013: 16 (list); Monserrat, 2013: 304 (rf).
Sympherobius conspersus Navás, 1909
Navás, 1908: 120 (key), 122 (d), 1909b: 378 (dis), 1914d: 188 (dis), 1917b: 87 (dis), 1919a: 194 (dis), 1921a: 65 (dis), 1921b: 151 (dis), 1923: 8 (dis); 1924b: 192 (key), 195 (dis, mf), 1925a: 92 (key), 94 (mf), 1928b: 99 (dis); Esben-Petersen, 1931: 4 (dis); Monserrat, 1977: 19 (list), 79 (rf); Monserrat & Triviño, 2013: 16 (list).
Sympherobius melanogaster Navás, 1915
Navás, 1915c: 250 (d), 1916a: 172 (dis), 1924b: 192 (key), 194 (dis, mf), 1925a: 92 (key), 93 (bio, dis, mf); Monserrat, 1977: 19 (list), 78 (bio, dis), 1986a: 1218 (rf, tx); Oswald, 1988a: 449 (list, rf); Monserrat & Triviño, 2013: 16 (list).
Sympherobius menendezi Navás, 1913
Navás, 1913c: 99 (d), 1915a: 31 (dis), 37 (dis); Monserrat & Triviño, 2013: 16 (list).
Sympherobius (Sympherobius) pygmaeus (Rambur, 1842)
Monserrat, 1978a: 175 (bio, dis), 1980b: 185 (bio, dis); Aspöck et al., 1980: 228 (rf); Monserrat, 1981: 153 (bio, dis), 1984a: 34 (bio, dis), 1984b: 174 (bio, dis), 1984d: 98 (bio, dis), 1984e: 159 (bio, dis), 1985b: 88 (bio, dis), 1985c: 92 (bio, dis), 1986a: 1215 (bio, dis), 1986b: 104 (bio, dis); Díaz-Aranda et al., 1986a: 1125 (bio, dis), 1986b: 1137 (bio, dis); Monserrat, 1987: 136 (bio, dis), Monserrat & Díaz-Aranda, 1987: 179 (bio, dis), 1988: 90 (bio, dis); Díaz-Aranda & Monserrat, 1988a: 117 (bio, dis), 1988b: 221 (bio, dis), 1988c: 219 (bio, dis); Monserrat & Díaz-Aranda, 1989: 51 (bio, dis); Marín & Monserrat, 1989: 292 (bio, dis), 1990: 223 (bio, dis), 1991a: 181 (bio, dis); Canard et al., 1992: 97 (dis); H. Aspöck et al., 2001: 148 (rf); Monserrat & Triviño, 2013: 16 (list).
Sympherobius venustus Navás, 1908
Navás, 1908: 121 (key), 123 (d); Andréu, 1911: 59 (dis); Monserrat & Triviño, 2013: 16 (list).
Sympherobius pygmaeus venusta Navás, 1908
Navás, 1924b: 193 (dis, mf), 1925a: 93 (dis, mf); Vidal y López, 1943: 22 (dis); Monserrat & Triviño, 2013: 16 (list).
Sympherobius venosus Navás, 1908
Navás, 1908: 121 (key), 123 (d); Andréu, 1911: 59 (dis); Monserrat & Triviño, 2013: 16 (list).
Nuevo material estudiado: ESPAÑA: Almería, Amoladeras, 6.VII.2013, 1♀ sobre Tamarix, Tabernas, Rambla Roja, 30SWG50, 400 m, 7.VII.2013, 1♀ sobre Tamarix. Granada, La Herradura, Punta de la Mona, 30SVF36, 200 m, 29.VII.2013, 1♀ a la luz. Madrid, Rivas Vaciamadrid, 8.VII.2013, 1♂, J.I.L. Colón.
Es una especie de tamaño y de pigmentación antenal y alar muy variable, incluso con cierta asociación entre estos caracteres y el medio donde estos ejemplares se hallan (ejemplo tenemos en la forma gratiosus, siempre asociada a vegetación arbórea de rivera sobre sauces y en particular sobre chopos y álamos), pero no hemos encontrado diferencias genitales que permitan su consideración taxonómica. Otra cuestión es que posteriores estudios moleculares demuestren otra cosa, y de hecho, Morinière et al. (2014) sugieren la existencia de potenciales especies crípticas relacionadas con esta especie. Tampoco tenemos demasiado claro y seguimos manifestando nuestras dudas de que esta especie y su afín, históricamente separadas, asumidas y diferenciadas: Sympherobius elegans (Stephens, 1836), no se trate en realidad del mismo taxón. Los ejemplares típicos de ambas especies se diferencian bien, pero la variabilidad en los ejemplares de una y otra especie se solapan y hacen muy subjetiva la decisión.
Especie de distribución holomediterránea expansiva, desde Canarias hasta Irán, Turkmenistán, Azerbaiján y Kazajstán. Marcadamente eurioica, puede hallarse casi sobre todo tipo de sustratos vegetales no herbáceos. Prácticamente citada a lo largo de todo el año, en Europa está mayoritariamente citada entre III-X, en altitudes de hasta 1500 m (hasta 2300 m en Canarias). En la fauna ibero-balear posee una amplia distribución, y ha sido citada entre III-X, en altitudes que oscilan entre 10-2050 m.
El huevo y la larva de esta especie fueron descritos por Withycombe (1923), Killington (1937), Gepp (1990), y New (1968a) describe la pupa.
Sympherobius pellucidus (Walker, 1853) (Figs. 93, 104)
Killington, 1937: 124 (rf); Zelený, 1962a: 62 (rf), 1963: 59 (rf); Hölzel, 1964: 135 (rf); Principi, 1966: 374 (rf); Monserrat et al., 1994: 49 (bio, dis); Monserrat, 1996b: 13 (list); Monserrat & Marín, 1996a: 777-785 (bio), 2001: 424-431 (bio, dis); Monserrat, 2004: 10 (bio, dis); Monserrat & Triviño, 2013: 16 (list), 67 (dis); Monserrat et al., 2013a: 53 (bio, dis), 2013b: 163 (bio, dis).
Nieremberge pellucida (Walker, 1853)
Navás, 1916d: 154 (dis), 1917a: 166 (dis, list, tax), 1917b: 87 (dis), 1917c: 40 (bio, dis), 1918: 41 (dis), 1919a: 194 (dis), 1922b: 109 (dis), 1924b: 198 (key), 199 (dis, mf), 1925a: 95 (dis, key, mf), 1929b: 32 (dis), Monserrat & Triviño, 2013: 16 (list).
Niremberge pellucida (Walker, 1853)
Bohigas & Sanchez, 1917: 317 (dis)
Sympherobius (Nieremberge) pellucidus (Walker, 1853)
Monserrat, 1986a: 1216 (rf); Marín & Monserrat, 1989: 292 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Sympherobius (Niremberge) pellucidus (Walker, 1853)
Aspöck et al., 1980: 231 (rf); Monserrat, 1984a: 46 (rf); Canard et al., 1992: 97 (dis); H. Aspöck et al., 2001: 151 (rf).
Especie mediterránea septentrional, probablemente holomediterránea. Generalmente citada sobre coníferas (Picea, Abies, Pinus), pero también sobre planifolios (Fagus, Quercus, Acer, Carpinus, Crataegus, etc.). Está mayoritariamente citada entre IV-IX, en altitudes de hasta 1800 m. En nuestra fauna posee una clara tendencia eurosiberiana, y ha sido citada sobre Abies y Cedrus, entre VII-VIII, en altitudes que oscilan entre 520-1960 m.
La larva de esta especie fue descrita por New (1967a).
Sympherobius fuscescens (Wallengren, 1863) (Figs. 29, 90, 103)
Killington, 1937: 131 (rf); Zelený, 1962a: 61 (rf), 1963: 58 (rf); Monserrat, 1977: 19 (list), 76 (key), 80 (bio, dis); Morgan, 1980: 119 (dis); Díaz-Aranda et al., 1986a: 1125 (bio, dis); Monserrat, 1991b: 110 (bio, dis); Marín & Monserrat, 1991b: 192 (dis); Monserrat, 1994: 21 (bio, dis); Marín, 1994: 254-302 (bio, dis); Monserrat et al., 1994: 49 (bio, dis); Monserrat, 1996b: 13 (list); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio), 2001: 424-431 (bio, dis); Monserrat & Triviño, 2013: 16 (list), 65 (dis); Monserrat et al., 2013a: 53 (bio, dis), 2013b: 163 (bio, dis).
Sympherobuis (Niremberge) fucescens (Wallengren, 1863)
Monserrat, 1984a: 34 (bio, dis).
Hemerobius inconspicuus McLachlan, 1868
Lucas, 1905: 298 (dis); Monserrat, 1977: 19 (list), 82 (rf); Monserrat & Triviño, 2013: 16 (list).
Nieremberge inconspicua (McLachlan, 1868)
Navás, 1916d: 154 (bio, dis), 1917a: 166 (list, rf), 1918: 41 (dis), 1924b: 198 (dis, key, mf), 1924c: 130 (dis), 1925a: 95 (dis, key, mf); Monserrat & Triviño, 2013: 16 (list).
Niremberge inconspicua (McLachlan, 1868)
Bohigas & Sanchez, 1917: 317 (dis)
Nieremberge limpida Navás, 1909
Navás, 1909b: 377 (d); Monserrat & Triviño, 2013: 16 (list).
Nieremberge limpidus Navás, 1909
Monserrat, 1977: 19 (list), 82 (rf).
Sympherobius (Nieremberge) fucescens (Wallengren, 1863) (lapsus)
Monserrat, 1984a: 34 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Sympherobius (Niremberge) fuscescens (Wallengren, 1863) (lapsus)
Monserrat & Díaz-Aranda, 1988: 90 (bio, dis).
Sympherobius (Niremberge) fuscescens (Wallengren, 1863)
Aspöck et al., 1980: 230 (rf); Monserrat, 1986a: 1216 (bio, dis); Díaz-Aranda et al., 1986b: 1138 (bio, dis); Díaz-Aranda & Monserrat, 1988a: 117 (rf), 1988b: 221 (bio, dis); Monserrat & Díaz-Aranda, 1989: 51 (bio, dis); Canard et al., 1992: 97 (dis); H. Aspöck et al., 2001: 151 (rf).
Sympherobius (Sympherobius) fuscescens (Wallengren, 1863)
Marín & Monserrat, 1991a: 181 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Especie sibérica conocida de Europa, Anatolia, Kazajstán y Japón. Asociada a coníferas, especialmente a Pinus. Está mayoritariamente citada entre VI-IX, en altitudes de hasta 2100 m. En nuestra fauna está ampliamente distribuida con cierta tendencia más mediterránea que atlántica, y ha sido citada entre V-IX, en altitudes que oscilan entre 300-2100 m.
El huevo de esta especie fue descrito por Withycombe (1923) y la larva por Killington (1931, 1937).
Sympherobius fallax Navás, 1908 (Figs. 1, 2, 94, 102)
Monserrat, 1990b: 78 (bio, dis), 1991b: 110 (bio, dis), 1994: 22 (bio, dis, tx); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio), 2001: 424-431 (bio, dis); Monserrat & Deretsky, 1999: 49 (bio, dis); Monserrat, 2004: 11 (bio, dis), 2005: 76 (rf), 2008a: 243 (dis); Monserrat & Triviño, 2013: 16 (list), 65 (dis); Letardi et al., 2013: 36 (list); Monserrat et al., 2013b: 163 (bio, dis); Monserrat, 2013: 290 (bio, dis).
Nephasitus fallax (Navás, 1908)
Navás, 1927a: 97 (dis); Monserrat & Triviño, 2013: 16 (list).
Nefasitus fallax (Navás, 1908)
Navás, 1930b: 162 (dis, rf).
Nephasitus fallans (Navás, 1908) (lapsus)
Vidal y López, 1943: 22 (dis); Monserrat & Triviño, 2013: 16 (list).
Nephasitus tenellus (Navás, 1908)
Navás, 1924b: 196 (dis, mf), 1925a: 94 (dis, mf); Vidal y López, 1943: 22 (dis); Monserrat & Triviño, 2013: 16 (list).
Sympherobius tenellus Navás, 1908
Navás, 1908: 120 (key), 121 (d); Andréu, 1911: 59 (dis); Tjeder, 1939: 3 (rf), 24 (rf); Monserrat & Triviño, 2013: 16 (list).
Sympherobius (Sympherobius) fallax Navás, 1908
Aspöck et al., 1980: 229 (rf); Monserrat, 1984d: 97 (bio, dis), 1985b: 92 (rf), 1986a: 1216 (dis); Díaz-Aranda & Monserrat, 1988c: 219 (bio, dis); H. Aspöck et al., 2001: 150 (rf); Monserrat & Triviño, 2013: 16 (list).
Nuevo material estudiado: ESPAÑA: Almería, Rambla del Retamar, 14.VI.2013, 1♀ a la luz, F. Acevedo. Granada, La Herradura, Punta de la Mona, 30SVF36, 200 m, 29.VII.2013, 1♀ en el interior de una vivienda (ejemplar del que se obtuvieron los datos ahora anotados y multitud de ejemplares, más de 30, ex ovo), 16.VIII.2013, 1♀, 28.VIII.2013, 1♀, 14.VII.2014, 1♀, 24.VII.2014, 1♂, 1.IX.2014, 1♀, todos a la luz. Zaragoza, Zaragoza, 21.IV.2007, 1♀, Isidro Martínez (Figs. 1, 2).
Especie de distribución circum-sahariana expansiva, siendo conocida de las zonas xéricas meridionales del Paleártico Occidental, desde la Macaronesia y norte de África a Pakistán, y desde el sur de la Región Afrotropical a Sudán, Etiopía, Arabia Saudí y Yemen. De morfología bastante variable, su biología es poco conocida, siempre está asociada a medios xéricos, y ha sido mayoritariamente capturada a la luz, también ocasionalmente sobre Ceratonia, Ficus, Persea, Salix, Solanum, Psidium, Albizzia, Citrus, Hibiscus o gramíneas. Dada su extensa distribución geográfica, ha sido recolectada a lo largo de todo el año, según latitudes, pero está mayoritariamente citada entre V-X, en altitudes relativamente bajas, mayoritariamente costeras, en zonas subsaharianas hasta 1300 m. En nuestra fauna posee una marcada tendencia mediterránea/térmica, y ha sido citada en altitudes que oscilan entre 10-940 m, y en la península posee actividad de los imagos practicamente a lo largo de todo el año, al menos en el sur de España, entre I-XI, habiendo sido citada en enero de Espinardo (Murcia) (Monserrat, 1986) y en octubre y noviembre de La Herradura (Granada) (Monserrat, 2004; Monserrat et al., 2013b), donde ha sido observada predando activamente (larvas e imagos) sobre colonias de cóccidos.
Como de S. amicus Navás, 1915, datos del huevo y la larva de esta especie fueron descritos por Rivnay (1943) y la morfología de la larva por Bodenheimer (1930). Aportamos ahora nuevos datos sobre su biología y desarrollo, a partir de una hembra recolectada en Granada: La Herradura, Punta de la Mona, 30SVF36, 200 m, el 29.VII.2013, en interior de vivienda (a la luz). Mantenido el proceso en condiciones ambientales, ese día puso varios huevos sobre el borde de una hoja con cóccidos que se le proporcionó para su alimento o entre el algodón de transpiración utilizado en el recipiente que la contenía, y siguió poniendo tandas de huevos durante los 25 días que se mantuvo con vida, generalmente en el borde o bajo las hojas, normalmente aislados, pero a veces en grupos de hasta tres o cuatro unidades. Los huevos eran de color blanco pálido con micrópilo más pardo, y tardaban 6 días en eclosionar. Las larvas neonatas eran muy activas y casi transparentes, con cabeza negruzca dorsalmente y región ventral pálida. Conforme progresaba su desarrollo siguen siendo pálidas, salvo leves anillos pardos en el abdomen, y caminan activamente oscilando lateralmente la cabeza buscando presas y ayudándose del extremo abdominal para desplazarse. Para su desarrollo se les proporcionaron hojas infestadas de cóccidos en diferentes estadios, que predaban ad libitum, observando que empujan activamente para acceder al insecto, y alguna incluso se introducía en algún capullo del cóccido para seguir comiendo. Completaban su desarrollo en 10 días y tras pupar, emergían los imagos en 9-10 días.
Sympherobius gayi Navás, 1910 (Figs. 20, 97, 107)
Monserrat, 1998: 131, 132 (rf, tx); Monserrat & Deretsky, 1999: 50 (bio, dis); Monserrat, 2008a: 243 (rf); Monserrat & Triviño, 2013: 16 (list), 24 (rf), 66 (dis); Letardi et al., 2013: 36 (list); Monserrat et al., 2013b: 159 (dis), 162 (bio, dis).
Sympherobius maculipennis Kimmins, 1929
Monserrat, 1991b: 111 (bio, dis), 1998: 131, 132 (rf, tx); Monserrat & Marín, 1996a: 777-785 (bio); Monserrat & Deretsky, 1999: 50 (rf); Monserrat & Triviño, 2013: 16 (list).
Sympherobius (Sympherobius) gayi Navás, 1910
H. Aspöck et al., 2001: 150 (rf).
Especie eurioica, originariamente neotropical, y conocida de Chile, Argentina, Uruguay, Paraguay, Brasil, Bolivia y Perú (Kimmins, 1929a; Nakahara, 1966b; Monserrat, 1998, 2003, 2008a), que ha sido introducida como agente de control en Nigeria, y accidentalmente o por acción humana en la Isla de Pascua y en Portugal: Monserrat (1991b) la cita del Algarve: Patacão, Faro, y de los alrededores de Lisboa: Oeiras, y Monserrat & Deretsky (1999) de Estremadura: Mafra. En estas poblaciones lusas, esta especie parece ser abundante en plantaciones de Citrus sinensis (Rutaceae) y sobre colonias de Planococcus volvae (Homoptera: Pseudococcidae) sobre Chamaecyparis sp. (Cupressaceae), y por ello estas poblaciones parecen estar aparentemente establecidas (Monserrat, 1991b; Monserrat & Deretsky, 1999), y por su marcada euroicidad (Monserrat, 1998), es muy probable que se encuentren en fase de expansión y por ello no se descartan nuevas citas. En su zona original está citada prácticamente a lo largo de todo el año, hasta 1400 m. En la zona en estudio la especie está citada en II, VI, XI, desde 25-200 m.
El huevo de esta especie fue descrito por Monserrat (2008b) y sus estadios larvarios por Monserrat (2003).
Sympherobius riudori Navás, 1915 (Figs. 92, 101)
Navás, 1915a: 50 (d); Aspöck et al., 1980: 10 (dis), 11 (dis); Oswald, 1988a: 450 (list, rf); Monserrat, 1990b: 79 (bio, dis), 1991b: 111 (bio, dis), 1994: 23 (bio, dis), 1996b: 13 (list); Monserrat & Marín, 1996a: 777-785 (bio), 2001: 424-431 (bio, dis); Monserrat, 2004: 11 (bio, dis), 2008a: 243 (bio, dis); Monserrat & Triviño, 2013: 16 (list), 68 (dis); Letardi et al., 2013: 36 (list); Monserrat et al., 2013b: 163 (bio, dis); Monserrat, 2013: 290 (rf).
Sympherobius (Nieremberge) riudori Navás, 1915
Monserrat & Triviño, 2013: 16 (list).
Sympherobius (Nieremberge) ruidori Navás, 1915 (lapsus)
Monserrat & Triviño, 2013: 16 (list).
Sympherobius (Niremberge) riudori Navás, 1915
Aspöck et al., 1980: 232 (rf); Monserrat, 1985b: 88 (bio, dis), 1986a: 1216 (bio, dis), 1987: 136 (bio, dis); Díaz-Aranda & Monserrat, 1988a: 117 (bio, dis), 1988b: 222 (rf), 1988c: 219 (bio, dis); H. Aspöck et al., 2001: 152 (rf).
Elemento mediterráneo occidental, inicialmente considerado como ibérico, recientemente citado en Francia meridional e Italia septentrional (Gruppe, 2007; Badano, 2010). En nuestra fauna es un elemento muy escasamente citado, con marcada tendencia meridional-mediterránea y algunas citas en medios atlánticos, y es de biología casi desconocida, habiendo sido capturado mayoritariamente a la luz, y sobre Juniperus oxicedrus, Pinus halepensis, P. nigra, ocasionalmente sobre Quercus ilex, y en madera y suelo de Fagus sylvatica en descomposición. Esta especie está mayoritariamente citada entre V-VIII, en altitudes bajas de hasta 1000 m. En nuestra fauna ha sido citada entre IV-IX, en altitudes que oscilan entre 40-2000 m.
Sympherobius klapaleki Zelený, 1963 (Figs. 91, 100)
Monserrat, 1977: 19 (list), 77 (key), 78 (dis), 1991b: 112 (bio, dis); Marín & Monserrat, 1991b: 192 (dis); Monserrat et al., 1994: 49 (bio, dis); Monserrat & Marín, 1996a: 777-785 (bio); Monserrat, 1996b: 14 (list); Monserrat & Deretsky, 1999: 50 (bio, dis); Marín & Monserrat, 1995a: 115 (bio, dis); Monserrat & Marín, 2001: 424-431 (bio, dis); Monserrat, 2008a: 244 (bio, dis); Ocharan et al., 2012: 424 (rf); Monserrat & Triviño, 2013: 16 (list), 24 (rf), 66 (dis); Monserrat et al., 2013a: 53 (rf), 2013b: 164 (bio, dis).
Sympherobius (Nieremberge) klapaleki Zelený, 1963
Monserrat, 1978a: 175 (bio, dis); Díaz-Aranda et al., 1986b: 1138 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Sympherobius (Niremberge) klapaleki Zelený, 1963
Aspöck et al., 1980: 231 (rf); Monserrat, 1984a: 34 (bio, dis), 1986a: 1217 (bio, dis, tx); Díaz-Aranda et al., 1986b: 1138 (bio, dis); Marín & Monserrat, 1989: 292 (bio, dis); Canard et al., 1992: 97 (dis); H. Aspöck et al., 2001: 152 (rf).
Sympherobius hyalinus Monserrat, 1976
Monserrat, 1976a: 200 (d), 1977: 19 (list), 76 (key), 78 (dis); Aspöck et al., 1980: 231 (tx); Oswald, 1988a: 448 (rf), 449 (list); Monserrat & Triviño, 2013: 16 (list).
Sympherobius outereloi Monserrat, 1976
Monserrat, 1976b: 16 (d), 1986a: 1217 (tx); Oswald, 1988a: 449 (list, rf); Monserrat & Triviño, 2013: 16 (list).
Especie mediterránea septentrional. Muy poco conocida y escasamente citada. Está mayoritariamente citada entre V-IX, en altitudes generalmente bajas, de hasta 1000 m. En nuestra fauna posee una clara tendencia eurosiberiana, con citas puntuales algo más meridionales, y ha sido hallada en medios húmedos sobre robles, encinas, castaños y avellanos, entre V-IX, en altitudes que oscilan entre 95-1390 m.
Microminae Krüger, 1922
La división de varios subgéneros dentro del género Micromus (entre los que nos afectan: Micromus s.str. Rambur, 1842, Nesomicromus Perkins, 1899, Eumicromus Nakahara, 1915, Pseudomicromus Krüger, 1922) en base a elementos de la venación alar no tiene correspondencia con las estructuras genitales, y por ello no han sido considerados.
Micromus paganus (Linnaeus, 1767) (Figs. 21, 114)
Navás, 1914a: 40 (dis), 1914b: 35 (dis), 1916c: 189 (dis), 1916d: 154 (dis); Bohigas & Sanchez, 1917: 317 (dis); Navás, 1918: 41 (dis), 1922b: 110 (dis), 1924b: 213 (key), 215 (dis, mf), 1925a: 106 (dis, key, mf), 1928b: 99 (dis); Zelený, 1963: 57 (rf); Monserrat, 1990b: 77 (dis), 1994: 20 (dis), 1996b: 13 (list); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio), 2001: 424-431 (bio, dis); H. Aspöck et al., 2001: 161 (rf); Letardi et al., 2013: 36 (list); Monserrat & Triviño, 2013: 16 (list), 63 (dis); Monserrat, 2013: 290 (rf).
Eumicromus paganus (Linnaeus, 1767)
Killington, 1936: 269 (rf); Monserrat & Triviño, 2013: 16 (list).
Micromus (Nesomicromus) paganus (Linnaeus, 1767)
Aspöck et al., 1980: 223 (rf); Monserrat, 1986a: 1213 (dis); Díaz-Aranda & Monserrat, 1988c: 219 (dis); Marín & Monserrat, 1989: 292 (bio, dis); Monserrat et al., 1994: 48 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Micromus (Eumicromus) paganus (Linnaeus, 1767)
Hölzel, 1964: 117 (rf); Monserrat & Triviño, 2013: 16 (list).
Stenomicromus paganus (Linnaeus, 1767)
Monserrat, 1977: 19 (list), 73 (rf); Monserrat & Triviño, 2013: 16 (list).
Especie sibérica. Recolectada sobre una gran variedad de sustratos vegetales, está mayoritariamente citada entre V- X, en altitudes de hasta 2000 m. En nuestra fauna ha sido puntualmente citada sobre planifolios, aunque debe desarrollarse en vegetación baja, principalmente herbácea, y ha sido recolectada entre VI-VIII, en altitudes que oscilan entre 10-1515 m.
El huevo y la larva de esta especie fueron descritos por Withycombe (1923) y Killington (1936).
Micromus variegatus (Fabricius, 1793) (Figs. 7, 22, 115)
Navás, 1908: 116 (dis, mf), 1915a: 42 (dis), 1916a: 173 (dis), 1916d: 154 (dis); Bohigas & Sanchez, 1917: 317 (dis); Navás, 1918: 41 (dis), 1919a: 194 (dis), 1921b: 151 (dis), 1923: 8 (dis), 1924b: 213 (dis, key, mf), 1924d: 25 (dis), 1925a: 105 (key), 106 (dis, mf), 1927a: 98 (dis), 1930a: 51 (dis); Nagler, 1958: 302 (rf); Zelený, 1962a: 62 (rf), 1963: 57 (rf); Principi, 1966: 373 (rf); Monserrat, 1990b: 77 (dis), 1993: 514 (bio, dis), 1994: 20 (bio, dis), 1996b: 13 (list); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio), 2001: 424-431 (bio, dis); H. Aspöck et al., 2001: 159 (rf); Monserrat, 2004: 16 (dis), 2008a: 249 (bio, dis); Ocharan et al., 2012: 424 (rf); Monserrat & Triviño, 2013: 16 (list), 24 (rf), 63 (dis); Letardi et al., 2013: 36 (list); Monserrat et al., 2013a: 53 (bio, dis), 2013b: 164 (bio, dis); Monserrat, 2013: 305 (rf).
Hemerobius variegatus Fabricius, 1793
Cuní y Martorell, 1880: 221 (dis), 242 (dis), 1888: 163 (dis), 1890: 14 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Micromus (Micromus) variegatus (Fabricius, 1793)
Aspöck et al., 1980: 221 (rf); Monserrat, 1986a: 1212 (bio, dis); Díaz-Aranda & Monserrat, 1988b: 222 (dis), 1988c: 219 (rf); Marín & Monserrat, 1989: 292 (bio, dis); Núñez Pérez et al., 1992: 389 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Nuevo material estudiado: ESPAÑA: A Coruña, Coirós, 31.V.2008, 1♂, J. R. Pato (Fig. 7). Huesca, Benasque, 11.VIII.2007, 1♀, I. Martínez.
Especie paleártica que probablemente ha sido introducida en la British Columbia (Canadá), y recientemente citada de su región oriental (Klimaszewski et al., 2009). Habitualmente asociada a medios boscosos y húmedos, generalmente sobre vegetación herbácea. Está citada sobre una amplia gama de sustratos vegetales, mayoritariamente recolectada entre IV-XI, en altitudes de hasta 1600 m. En nuestra fauna tiene una clara tendencia eurosiberiana con citas puntuales algo más meridionales, y ha sido citada entre IV-XI, en altitudes que oscilan entre 20-1300 m.
El huevo y la larva de esta especie fueron descritos por Brauer (1871), Withycombe (1925), Killington (1936), Kimmins (1939a), Dunn (1954), Duelli (1986) y Gepp (1999).
Micromus angulatus (Stephens, 1836) (Figs. 6, 9, 117)
Marín & Monserrat, 1987: 350-359 (bio, dis); Monserrat, 1990b: 77 (dis), 1991b: 109 (dis), 1993: 479 (bio, dis), 1994: 20 (bio, dis); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio), 2001: 424-431 (bio, dis); H. Aspöck et al., 2001: 160 (rf); Alvis et al., 2003: 186 (bio, dis); Monserrat, 2004: 16 (bio, dis), 2008a: 249 (bio, dis); Ocharan et al., 2012: 424 (bio, dis); Letardi et al., 2013: 36 (list); Monserrat & Triviño, 2013: 16 (list), 24 (rf), 62 (dis); Monserrat et al., 2013b: 164 (bio, dis).
Eumicromus angulatus (Stephens, 1836)
Killington, 1936: 263 (rf); Miermont & Canard, 1975: 180 (rf); Monserrat & Triviño, 2013: 16 (list).
Micromus aphidivorus Schrank, 1781
Dziędzielewicz, 1891: 99 (rf); Navás, 1908: 117 (dis, mf), 1924b: 213 (key), 214 (dis, mf), 1925a: 105 (key), 106: (dis, mf), 1927a: 98 (dis); Monserrat, 1977: 19 (list), 73 (rf); Monserrat & Triviño, 2013: 16 (list).
Micromus (Eumicromus) angulatus (Stephens, 1836)
Hölzel, 1964: 117 (rf); Monserrat & Triviño, 2013: 16 (list).
Micromus (Nesomicromus) angulatus (Stephens, 1836)
Aspöck et al., 1980: 222 (rf); Monserrat, 1985c: 92 (bio, dis), 1986a: 1213 (bio, dis), 1987: 135 (bio, dis); Marín & Monserrat, 1989: 292 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Micromus (Pseudomicromus) angulatus (Stephens, 1836)
Monserrat, 1978a: 173 (bio, dis); Monserrat & Triviño, 2013: 16 (list).
Pseudomicromus angulatus (Stephens, 1836)
Monserrat, 1977: 18 (list).
Nuevo material estudiado: ESPAÑA: A Coruña, Coirós, 29.III.2008, 1♀, J.R. Pato (Fig. 9). Granada, La Herradura, Playa de Cantarriján, 30SVF36, 10 m, 9.VII.2013, 1♂ a la luz. Tarragona, La Selva del Camp, 41°13′07.67″N 1°08′36.94″E, 224 m, 18.VI.2007, 1♂ sobre Citrus clementina, N.Cañellas, 16.VI.2010, 1♀ sobre Citrus clementina, N. Cañellas, 17.VII.2010, 1♂, sobre Citrus, N.Cañellas. Zaragoza, Zaragoza, 3.I.2014, 1♂, I. Martínez (Fig. 6).
Elemento holártico. Su biología es poco conocida, aparentemente eurioica, y probablemente asociada a vegetación arvense y/o herbácea, aunque ha sido citada sobre robles, avellanos, etc. Está citada a lo largo de todo el año, en altitudes de hasta 1500 m. En nuestra fauna posee una amplia distribución, y ha sido citada en altitudes que oscilan entre 10-1480 m, mayoritariamente entre IV-XI, aunque en algunas zonas, especialmente litorales y meridionales posee actividad durante todo el año (I-XII), abarcando desde el mes de enero, La Herradura (Granada), febrero, Alcalá de Henares (Madrid) a noviembre, Los Molinos, Rivas Vaciamadrid (Madrid) y diciembre, Algarrobo (Málaga) (Monserrat, 1986b, 1993, 2008; Monserrat et al., 2013b). Ahora citamos un imago en actividad en el mes de enero en Zaragoza.
Como Micromus aphidivorus, Eumicromus angulatus o Micromus angulatus los estadios larvarios de esta especie fueron descritos por Aubrook (1935) y Killington (1936), Fraser (1940) y Miermont & Canard (1975).
Micromus lanosus (Zelený, 1962) (Fig. 116)
Monserrat, 1991b: 109 (bio, dis), 1993: 498 (bio, dis), 1994: 20 (bio, dis), 1996b: 13 (list); Monserrat & Marín, 2001: 424-431 (bio, dis); H. Aspöck et al., 2001: 162 (rf); Ocharan et al., 2012: 424 (bio, dis); Monserrat & Triviño, 2013: 16 (list), 62 (dis); Monserrat et al., 2013b: 164 (bio, dis).
Micromus (Nesomicromus) lanosus (Zelený, 1962)
Monserrat, 1984a: 36 (dis), 1986a: 1214 (bio, dis); Popov, 1986b: 328 (dis, rf); Canard et al., 1992: 97 (dis); Monserrat et al., 1994: 48 (bio, dis); Monserrat & Marín, 1996a: 777-785 (bio); Monserrat & Triviño, 2013: 16 (list).
Elemento europeo extra-mediterráneo poco conocido. Asociado a medios boscosos y húmedos, probablemente a vegetación baja. Sobre muy variados sustratos vegetales, está mayoritariamente citada entre VI-VIII, en altitudes de hasta 1500 m. En nuestra fauna ha sido mayoritariamente citada en el tercio septentrional, entre VII-X, en altitudes que oscilan entre 720-1960 m. Esta especie es muy poco conocida de la Fauna Ibérica, únicamente ha sido citada sobre avellano, abedul y roble de Huesca y Lérida, sobre ortiga en Ávila (Monserrat, 1984a, 1986a, 1991b, 1993, 1994; Monserrat et al., 1994, 2013b) y recientemente en un hayedo de Asturias (Ocharan et al., 2012). Probable habitante de estratos herbáceos en medios eurosiberianos.
La larva fue descrita por Gepp (1999).
Megalominae Krüger, 1922
Megalomus hirtus (Linnaeus, 1761) (Figs. 3, 111)
Dziędzielewicz, 1891: 102 (rf); Novak, 1891: 53 (rf); Vicente, 1902: 188 (dis); Lucas, 1905: 298 (dis); Navás, 1913a: 82 (dis), 1916c: 189 (dis), 1917c: 40 (dis); Bohigas & Sanchez, 1917: 317 (dis); Navás, 1919a: 194 (dis), 1919c: 42 (dis), 1921b: 151 (dis), 1924b: 217 (key), 218 (dis, mf), 1924d: 25 (dis), 1925a: 107 (key), 108 (dis, mf), 1925b: 135 (dis), 1927a: 98 (dis), 1930b: 161 (dis), 1931a: 120 (dis); Killington, 1934b: 130 (rf), 1937: 141 (rf); Vidal y López, 1943: 23 (dis); Principi, 1958: 182 (rf); Nagler, 1958: 302 (rf); Berland, 1962: 79 (rf); Monserrat, 1977: 18 (list), 74 (key), 75 (dis); Aspöck et al., 1980: 196 (rf); Monserrat, 1980a: 173 (bio, dis), 1984a: 46 (rf), 1984b: 173 (bio, dis), 1984d: 112 (rf), 1984e: 159 (bio, dis), 1986a: 1202 (bio, dis), 1986b: 104 (dis); Díaz-Aranda & Monserrat, 1988a: 116 (rf); Séméria & Berland, 1988: 144 (rf); Marín & Monserrat, 1989: 291 (rf); Monserrat, 1991b: 103 (bio, dis); Canard et al., 1992: 96 (dis); Monserrat, 1994: 11 (dis), 1996b: 13 (list); Monserrat & Marín, 1996a: 777-785 (bio), 2001: 424-431 (bio, dis); H. Aspöck et al., 2001: 155 (rf); Whittington, 2002: 380 (rf); Monserrat, 2004: 16 (dis); Monserrat & Triviño, 2013: 16 (list), 60 (dis); Ocharan et al., 2012: 424 (rf); Monserrat et al., 2013a: 51 (dis), 2013b: 164 (bio, dis).
Nuevo material estudiado: ESPAÑA: Guipúzcoa, Oñati, Zabalaitz, Aizkorri-Aratz P.N., 30TWN5256, 1180 m, 26.VII.2014, 1♀ sobre Taxus baccata, S. Pagola. Muy probablemente a esta especie pertenecen los ejemplares fotografiados por I. Martínez (Fig. 3) en Castellón, Portell, 29.VIII.2009. Lérida, Llesuí, 4.VI.2014 (Fig. 3).
Especie europea extendida hasta Armenia. De biología poco conocida. Está mayoritariamente citada entre V-IX, en altitudes de hasta 1400 m. Probablemente asociada a vegetación herbácea en medios húmedos. En nuestra fauna posee una amplia distribución y ha sido recolectada sobre haya, sotobosque de robles, pinos, etc., entre VI-VIII, en altitudes que oscilan entre 480-2150 m.
El huevo y la larva de esta especie fueron descritos por Killington (1934b, 1936, 1937). La descrita por Dujardin (1851) como Hemerobius hirtus pertenece a Conwentzia (Coniopterygidae).
Megalomus pyraloides Rambur, 1842 (Fig. 113)
McLachlan, 1902b: 33 (dis); Navás, 1908: 117 (key), 118 (dis, mf); Andréu, 1911: 58 (dis); Principi, 1966: 374 (rf); Aspöck et al., 1980: 197 (rf); Monserrat, 1984d: 112 (rf), 1986a: 1203 (bio, dis); Díaz-Aranda & Monserrat, 1988c: 218 (rf); Monserrat, 1991b: 103 (dis); Dobosz, 1993: 170 (dis); Monserrat, 1994: 11 (bio, dis); Marín & Monserrat, 1995b: 38 (rf); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio), 2001: 424-431 (bio, dis); H. Aspöck et al., 2001: 156 (rf); Monserrat & Triviño, 2013: 16 (list), 60 (dis); Monserrat et al., 2013b: 164 (bio, dis); Monserrat, 2013: 290 (rf).
Megalomus montserraticus Navás, 1915
Navás, 1915b: 469 (d), 1924b: 218 (key), 220 (dis, mf), 1925a: 107 (key), 109 (dis, mf); Monserrat, 1985a: 240 (tx); Monserrat & Triviño, 2013: 16 (list).
Especie atlanto-adriato mediterránea conocida de España, Francia, Italia y Croacia. De biología poco conocida, generalmente asociada a medios xéricos. Está mayoritariamente citada entre V-X, en altitudes de hasta 1300 m. En nuestra fauna posee una clara tendencia meridional y mediterránea, y ha sido recolectada sobre muy diversa vegetación, entre V-IX, en altitudes que oscilan entre 40-2200 m.
Megalomus tineoides Rambur, 1842 (Fig. 112)
Rambur, 1842: 420 (d); Rosenhauer, 1856: 367 (dis); Hagen, 1866a: 430 (rf), 1866c: 297 (dis, rf); Brauer, 1876: 291 (rf); Navás, 1905c: 34 (dis, mf), 1908: 118 (dis, key), 1913a: 82 (dis), 1914c: 212 (dis), 1915b: 469 (rf), 470 (dis, mf); Bohigas & Sanchez, 1917: 317 (dis); Navás, 1924b: 217 (key), 219 (dis, mf), 1925a: 107 (key), 108 (dis, mf); Mosely, 1932b: 168 (rf); Nakahara, 1960a: 56 (dis); Monserrat, 1977: 18 (list), 74 (key), 75 (dis); Aspöck et al., 1980: 11 (dis), 197 (rf); Monserrat, 1986a: 1203 (dis), 1986b: 104 (dis), 1987: 136 (bio, dis); Monserrat & Díaz-Aranda, 1987: 179 (dis); Díaz-Aranda & Monserrat, 1988b: 222 (dis), 1988c: 218 (rf); Monserrat, 1990b: 87 (dis), 1991b: 103 (dis), 1994: 11 (dis), 1996b: 13 (list); Marín & Monserrat, 1995a: 114 (dis); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio); Letardi, 1997: 150 (rf); Monserrat & Marín, 2001: 424-431 (bio, dis); H. Aspöck et al., 2001: 155 (rf); Monserrat, 2004: 16 (bio, dis), 2008a: 249 (dis); Letardi et al., 2013: 36 (list); Monserrat & Triviño, 2013: 16 (list), 61 (dis); Monserrat et al., 2013a: 51 (dis), 2013b: 164 (bio, dis); Monserrat, 2013: 290 (rf).
Hemerobius tineoides (Rambur, 1842)
Walker, 1853: 281 (rf); Pictet, 1865: 57 (dis, mf), 108 (dis); Navás, 1904b: 143 (dis), 1905a: 506 (dis), 1909a: 175 (dis); Monserrat & Triviño, 2013: 16 (list).
Nuevo material estudiado: ESPAÑA: Zaragoza, Bagués, La Parueta, Vallatanso, 30TXN7212, 760 m, 26.VI.2014, 1♂ sobre Ononis fruticosa, S. Pagola.
Especie mediterránea expansiva, probablemente holomediterránea. De biología poco conocida, generalmente asociada a medios xéricos. Está mayoritariamente citada entre V-VIII, en altitudes de hasta 1000 m. En nuestra fauna posee una amplia distribución con tendencia mediterránea, y ha sido recolectada entre V-X, en altitudes que oscilan entre 100-1500 m.
Megalomus tortricoides Rambur, 1842 (Fig. 110)
McLachlan, 1903: 225 (dis); Navás, 1905b: 18 (dis), 1905c: 34 (dis, mf), 1908: 117 (key), 118 (dis); Macho Bariego, 1909: 75 (dis); Mosely, 1932a: 282 (dis); Principi, 1958: 183 (dis, rf); Aspöck et al., 1980: 196 (rf); Monserrat, 1984d: 112 (rf), 1986a: 1203 (bio, dis), 1991b: 103 (dis); Monserrat et al., 1994: 46 (bio, dis); Monserrat, 1994: 11 (bio, dis), 1996b: 13 (list); Monserrat & Marín, 1996a: 777-785 (bio), 1996b: 195 (bio), 2001: 424-431 (bio, dis); H. Aspöck et al., 2001: 155 (rf); Monserrat & Triviño, 2013: 16 (list), 61 (dis); Monserrat, 2013: 290 (rf).
Megalomus tener Navás, 1915
Navás, 1915b: 468 (d), 1919b: 52 (dis, mf), 1924b: 218 (key), 220 (dis, mf), 1925a: 108 (key), 109 (dis, mf); Eglin, 1941: 75 (rf, dis); Vidal y López, 1943: 23 (dis); Monserrat, 1977: 18 (list), 74 (key), 75 (rf), 1984d: 112 (rf), 1985a: 240 (tx); Monserrat & Triviño, 2013: 16 (list).
Especie europea extendida hasta Anatolia y Armenia. Está mayoritariamente citada entre V-IX, en altitudes de hasta 2000 m. En nuestra fauna posee una cierta tendencia mediterránea en su distribución, y ha sido recolectada entre V-VIII, en altitudes que oscilan entre 477-2220 m.
Elementos de su pupa fueron descritos por Gepp (1999).
Drepanepteryginae Krüger, 1922
Drepanepteryx phalaenoides (Linnaeus, 1758) (Figs. 11, 26, 98)
Navás, 1924b: 222 (¿rf?); Monserrat, 1984a: 34 (dis), 1986a: 1202 (bio, dis); Popov, 1986b: 324 (dis); Monserrat, 1991b: 102 (bio, dis); Canard et al., 1992: 96 (dis); Monserrat, 1996b: 13 (list); Monserrat & Marín, 1996a: 777-785 (bio), 2001: 424-431 (bio, dis); H. Aspöck et al., 2001: 157 (rf); Monserrat, 2010: 21 (mf), 24 (bio, dis); Ocharan & Ocharan, 2011: 350 (bio, dis, mf); Ocharan et al., 2012: 424 (rf); Monserrat & Triviño, 2013: 16 (list), 24 (rf), 54 (dis).
Drepanopteryx phalenoides (Linnaeus, 1758)
Navás, 1924b: 222 (¿rf?).
Especie sibérica, conocida desde la Península Ibérica y Canarias (muy probablemente introducida) a Japón. Considerada euroica, está generalmente asociada a caducifolios en medios boscosos y húmedos, también en espacios abiertos y huertos. Está mayoritariamente citada entre IV-XI, en altitudes de hasta 1000 m. En nuestra fauna es puntualmente conocida de su tercio septentrional (Pirineos y Cornisa Cantábrica), y ha sido recolectada (mayoritariamente a la luz) en medios con hayas y avellanos, en altitudes que oscilan entre 700-1560 m, entre V-VIII (XII). Su potencial capacidad de hibernar en estado de imago (Killington, 1937; Aspöck et al., 1980) parece corroborarse también en nuestra fauna, habida cuenta de la obtención de un imago entre hojarasca de haya recolectada en XII en Asturias (Ocharan & Ocharan, 2011).
Los estadios preimaginales de esta especie fueron descritos por Von Gleichen (1770), Standfuss (1910), Morton (1910) y Gepp (1990, 1999), y lo que se conocía entonces de sus estadios larvarios fue comentado por Killington (1937) y posteriormente descritos por Fulmek (1941).
Notiobiellinae Nakahara, 1960
Psectra diptera (Burmeister, 1839) (Figs. 15, 25, 99)
Navás, 1924b: 217 (¿rf?); Monserrat, 2004: 15 (bio, dis, mf); Tröger, 2007: 142 (dis), 2009: 81 (rf); Monserrat & Triviño, 2013: 16 (list), 24 (rf), 64 (dis).
Especie ampliamente distribuida en la Región Paleártica desde Europa extramediterránea a Japón, y probablemente introducida en Norte América, donde ha sido citada en la zona oriental de Canadá y Estados Unidos. Mayoritariamente capturada a la luz y generalmente sobre gramíneas y otras plantas herbáceas, a veces en medios rivereños, dunales, arenosos y/o entre raíces. Parece poseer cortos periodos de actividad como imagos, y se ha comentado que probablemente sus poblaciones son monovoltinas (Szentkirályi, 1997). Está mayoritariamente citada entre V-XI, en altitudes bajas (litorales) hasta 300 m. En la fauna ibérica sólo existen puntuales citas en las provincias de Guipúzcoa y Zaragoza, y ha sido citada entre V-X, en altitudes que oscilan entre 270-310 m, también sobre plantas herbáceas y de estepas y praderas. En nuestra fauna, al menos dos generaciones se han sugerido (Monserrat, 2004).
El huevo y la larva de esta especie fueron descritos por Killington (1946) y New (1966) aporta algunos datos.
Especies dudosa- o incorrectamente citadas en nuestra fauna:
Hemerobius (Brauerobius) marginatus Stephens, 1836 (Fig. 55)
Especie sibérica citada de la Europa extramediterránea y extendida por Georgia, Azerbaiyán hasta Siberia, Mongolia y Japón, no conocida (aún) de la Península Ibérica (H. Aspöck et al., 2001).
Las citas de esta especie en nuestra fauna son numerosas y han sido comentadas por Monserrat (1986a: 1217) y regogidas por Monserrat (1996b: 16; 2011: 172) y Monserrat & Triviño (2013: 16).
Como Hemerobius marginatus Stephens, 1836 está citada por Navás, 1905b: 18 (dis), 1905c: 35 (dis), 1908: 119 (key), 120 (dis, mf), 1909b: 376 (dis), 1910: 243 (dis), 1913b: 67 (dis), citas desestimadas o puestas en duda por Monserrat (1986a: 1218) o Makarkin & Monserrat (2007: 270), y Monserrat (2011: 172) sugiere que muy probablemente podrían tratarse de H. stigma.
Como Brauerobius marginatus (Stephens, 1836) está citada por Monserrat (1977: 102), cita que es corregida por Monserrat (1986a: 1207) y es asignada a Hemerobius gilvus Stein, 1863
Como Hemerobius (Brauerobius) marginatus Stephens, 1836 está citada por Monserrat (1996b: 16), quien recoge las opiniones de Monserrat (1986a).
No dudamos de su presencia en nuestra fauna, en particular en el tercio norte peninsular. Anotamos el aspecto de su genitalia masculina (Fig. 55) a la espera de que nuevo material confirme su presencia en nuestra fauna.
Hemerobius strigosus Zettersted (limbatus Br.) (sic)
Con esta extraña cita, sin duda Navás (1905c: 35) debe estar refiriéndose a Hemerobius strigosus Zetterstedt, 1840, y lo cita como: “raro en España”. Implícitamente parece citar esta especie, como tal, en nuestra fauna, y aparentemente considera una “especie” como sinónima posterior de ella: (limbatus Br.). No conocemos de esta familia ninguna especie con este nombre específico/autor, quizás pudiera estar refiriéndose a Hemerobius limbatus Wesmael, 1841. Hoy día tanto Hemerobius limbatus como Hemerobius strigosus son consideradas sinonimias de Hemerobius stigma Stephens, 1836.
Micromus catalaunicus (sic)
Navás (1931b: 238) cita esta “especie” de Pirineos. Debe tratarse de un error y referirse a Nephasitus catalaunicus (sic) Navás, 1930 (que posteriormente cita a continuación), especie sinónima de Sympherobius elegans (Stephens, 1836), cuyo tipo lista Monserrat (1985a: 240).
Micromus verrucivorus Schrank (sic)
Tal “especie” es citada por Navás (1924d: 25) de Hostalets. Probablemente se trate de un lapsus por Micromus aphidivorus (Schrank, 1781) nomen dubium, taxa vinculado con M. angulatus (Stephens, 1836).
AgradecimientosTOP
Esta contribución forma parte del Proyecto coordinado de I+D+i Fauna Ibérica (Neuroptera) CGL2010-22267-C07-05. Deseamos agradecer a los numerosos amigos y colegas, y especialmente a Johannes Gepp, Santiago Pagola, Jose Ignacio López Colón, Isidro Martínez, José Ramón Pato, Francisco Rodríguez, Xavier Espadaler y Edith Winkler por el envío de ejemplares y/o fotos de sus colecciones particulares o de sus centros de investigación. También a Fernando Acevedo por su colaboración en la obtención de alguno de los datos aportados, y a Eduardo Ruiz por su ayuda en el tratamiento de las imágenes.
ReferenciasTOP
| ○ |
Ábrahám, L., Markó, V. & Vas, J., 2003. Investigations on a neuropteroid community by using different methods. Acta Phytopathologica et Entomologica Hungarica, 38: 199-207. |
| ○ |
Ábrahám, L. & Mészáros, Z., 2006. Further Studies on the Daily Activity Pattern of Neuroptera with some Remarks on the Diurnal Activities. Acta Phytopathologica et Entomologica Hungarica, 41: 275-286. |
| ○ |
Ábrahám, L. & Vas, J., 1999. Preliminary report on study of the daily activity pattern of Neuroptera in Hungary. Acta Phytopathologica et Entomologica Hungarica, 34: 153-164. |
| ○ |
Agekyan, N. G., 1973. [Neuroptera feeding on bamboo aphids in Adzharia and their parasites.] Entomologicheskoe Obozrenie, 52: 549-564 (en ruso). |
| ○ |
Alayo, D. P., 1968. Los Neurópteros de Cuba. Poeyana, Serie B, 2: 1-127. |
| ○ |
Albarda, H., 1889. Catalogue raisonné et synonymique des Nevroptères, observés dans les Pays-Bas et dans les Pays limitrophes. Tijdschrift voor Entomologie, 32: 211-376. |
| ○ |
Alvis, L., Villalba, M., Marzal, C. & García-Marí, F., 2003. Identification and abundance of Neuropteran species associated with citrus orchards in Valencia, Spain. Integrated Control in Citrus Fruit Crops, 26, 6: 185-190. |
| ○ |
Andersen, T. & Greve, L., 1975. Neuroptera in light-traps at Osteroy, Hordaland. Norwegian Journal of Entomology, 22: 123-128. |
| ○ |
Andréu, J. [M.] 1911. Neurópteros de la provincia de Alicante. Una especie nueva. Boletín de la Sociedad Aragonesa de Ciencias Naturales, 10: 56-59. |
| ○ |
Aspöck, H., 1963. Zwei für Mitteleuropa neue Arten des Genus Kimminsia Kill. (Neuroptera, Hemerobiidae). Nachrichtenblatt der Bayerischen Entomologen, 12: 53-56 |
| ○ |
Aspöck, H. & Aspöck, U., 1965. Boriomyia helvetica nov. spec. (Insecta, Neuropt., Hemerobiidae) aus dem Unterengadin. Mit einer Übersicht über die mitteleuropäischen Species des Genus und Bemerkungen zu B. malladai Nav. und B. tjederi Kimm. Ergebnisse der Wissenschaftlichen Untersuchungen des Schweizerischen Nationalparks, 10: 209-220. |
| ○ |
Aspöck, H. & Aspöck, U., 1966. Neue Hemerobiiden aus Vorderasien (Insecta, Planipennia). Entomologisches Nachrichtenblatt, 13: 74-80. |
| ○ |
Aspöck, H., Aspöck, U. & Hölzel, H., 1980. Die Neuropteren Europas. 2 vols. Goecke & Evers. Krefeld. Volk. I 495 pp., vol. II 355 pp. |
| ○ |
Aspöck, H., Aspöck, U. & Rausch, H., 1991. Die Raphidiopteren der Erde. Eine monographische Darstellung der Systematik, Taxonomie, Biologie, Ökologie und Chorologie der rezenten Raphidiopteren der Erde, mit einer zusammenfassenden Übersicht der fossilen Raphidiopteren (Insecta: Neuropteroidea). 2 Vols. Goecke & Evers. Krefeld. 730 & 550 pp. |
| ○ |
Aspöck, H., Hölzel, H. & Aspöck, U., 2001. Kommentierter Katalog der Neuropterida (Insecta: Raphidioptera, Megaloptera, Neuroptera) der Westpaläarktis. Denisia, 2: 5-606. |
| ○ |
Aspöck, U., 1992. Crucial points in the phylogeny of the Neuroptera (Insecta). In: M. Canard, H. Aspöck & M. W. Mansell (eds.). Current Research in Neuropterology (Proceedings of the Fourth International Symposium on Neuropterology, June 1991, Bagnères-de-Luchon). Toulouse: 63-73. |
| ○ |
Aspöck, U., 1993. Geklärtes und ungeklärtes im system der Neuroptera (Insecta: Holometabola). Mitteilungen der Deutschen Gesellschaft für Allgemeine und Angewandte Entomologie, 8: 451-456. |
| ○ |
Aspöck, U., 1995. Neue hypothesen zum System der Neuropterida. Mitteilungen der Deutschen Gesellschaft für Allgemeine und Angewandte Entomologie, 10: 633-636. |
| ○ |
Aspöck, U., 1996. Classification and phylogeny of the Neuropteroidea: An introduction. Proceedings of the 20th International Congress of Entomology, Firenze: 30. |
| ○ |
Aspöck, U. & Aspöck, H., 1982. Eine neue Species des Genus Wesmaelius Krüger aus Spanien (Neuropteroidea: Planipennia: Hemerobiidae). Entomologische Zeitschrift, 92(20): 289-292. |
| ○ |
Aspöck, U. & Aspöck, H., 1999. Kamelhälse, Schlammfliegen, Ameisenlöwen. Wer sind sie? (Insecta: Neuropterida: Raphidioptera, Megaloptera, Neuroptera). Stapfia, 60: 1-34. |
| ○ |
Aspöck, U. & Aspöck, H., 2010. Landmarks towards a phylogeny-based classification of the Neuropterida (Insecta: Endopterygota). In: D. Devetak, S. Lipovšek & A. E. Arnett (eds.). (Proceedings of the 10th International Symposium on Neuropterology, June 2008, Piran). University of Maribor. Maribor: 67-74. |
| ○ |
Aspöck, U. & Aspöck, H., 2013. Nevrorthidae, Sisyridae, Coniopterygidae… – Der Streit um die niederen Ränge im Stammbaum der Neuroptera. DGaaE Nachrichten, 27: 19-20. |
| ○ |
Aspöck, U., Haring, E. & Aspöck, H., 2012. The phylogeny of the Neuropterida: long lasting and current controversies and challenges (Insecta: Endopterygota). Arthropod Systematics & Phylogeny, 70: 119-129. |
| ○ |
Aspöck, H. & Hölzel, H., 1996. The Neuropteroidea of North Africa, Mediterranean Asia and of Europe: a comparative review (Insecta). In: M. Canard, H. Aspöck & M. W. Mansell (eds.). Pure and Applied Research in Neuropterology (Proceedings of the Fifth International Symposium on Neuropterology, May 1994, Cairo). Toulouse: 31-86. |
| ○ |
Aspöck, U., Plant, J. D. & Nemeschkal, H. L., 2001. Cladistic analysis of Neuroptera and their systematic position within the Neuropterida (Insecta: Holometabola: Neuropterida: Neuroptera). Systematic Entomology, 26: 73-86. http://dx.doi.org/10.1046/j.1365-3113.2001.00136.x |
| ○ |
Attia, A. R. & El Arnaouty, S. A., 2008. Effect of different type of preys on the bioactivity of the predator Sympherobius amicus Navas (Neruoptera: Hemerobiidae). Egyptian Journal of Biological Control, 18: 61-64. |
| ○ |
Auber, J., 1956. Névroptères Planipennes récoltés en Côte-d’Ivoire par la mission Paulian-Delamare. Bulletin de l’Institut Française d’Afrique Noire (Série A, Sciences Naturelles), 18: 495-499. |
| ○ |
Aubrook, E. W., 1935. Notes on the biology of Micromus aphidivorus Schrank (Planipennia, Hemerobiidae). North Western Naturalist, 10: 34-36. |
| ○ |
Babrikova, T., 1984. Identification of the larvae of some species of Chrysopidae and Hemerobiidae families. Rastitelna Zashitita, 32: 42-46. |
| ○ |
Badano, D., 2010. Sympherobius riudori nuovo per l’Italia. Bollettino della Società Entomologica Italiana, 142: 7-9. |
| ○ |
Baert, L., Desender, K. & Peck, S. B., 1992. New data on the Neuroptera of the Galapagos Islands, Ecuador. Bulletin de l’Institut Royal des Sciences Naturelles de Belgique, Entomologie, 62: 143-147. |
| ○ |
Báez, M. & Oromí, P., 2010. Planipennia. In: M. Arechavaleta Hernández et al. (Coords.). Lista de especies silvestres de Canarias (hongos, plantas y animales terrestres). Gobierno de Canarias. La Laguna: 253-254. |
| ○ |
Banks, C. J., 1952. An analysis of captures of Hemerobiidae and Chrysopidae in suction traps at Rothamsted, July, 1949. Proceedings of the Royal Entomological Society of London, (A), 27: 45-53. |
| ○ |
Banks, N., 1905. A revision of the Nearctic Hemerobiidae. Transactions of the American Entomological Society, 32: 21-51. |
| ○ |
Banks, N., 1909. Hemerobiidae from Queensland, Australia [Neuroptera, Hemerobiidae.] Proceedings of the Entomological Society of Washington, 11: 76-81. |
| ○ |
Banks, N., 1910. New South American Neuropteroid Insects. Proceedings of the Entomological Society of Washington, 12: 146-160. |
| ○ |
Banks, N., 1913a. New exotic neuropteroid insects. Proceedings of the Entomological Society of Washington, 15: 137-143. |
| ○ |
Banks, N., 1913b. Synopses and descriptions of exotic Neuroptera. Transactions of the American Entomological Society, 39: 201-242. |
| ○ |
Banks, N., 1918. New neuropteroid insects. Bulletin of the Museum of Comparative Zoology, 62: 1-22. |
| ○ |
Banks, N., 1920. New neuropteroid insects. Bulletin of the Museum of Comparative Zoology, 64: 297-362. |
| ○ |
Banks, N., 1932. Concerning the genus Notiobiella (Neuropt.-Hemerobiidae). Psyche, 39: 103-106. |
| ○ |
Banks, N., 1937a. Philippine neuropteroid insects. Philippine Journal of Science, 63: 125-174. |
| ○ |
Banks, N., 1937b. Neuropteroid insects from Formosa. Philippine Journal of Science, 62: 255-291. |
| ○ |
Banks, N., 1940. Report on certain groups of neuropteroid insects from Szechwan, China. Proceedings of the United States National Museum, 88: 173-220. http://dx.doi.org/10.5479/si.00963801.88-3079.173 |
| ○ |
Bänsch, R., 1964. Das Beutefangverhalten der aphidivoren Hemerobiidenlarven. Zoologischer Anzeiger, 173: 278-281. |
| ○ |
Barnard, P. C., 1978. A check-list of the British Neuroptera with taxonomic notes. Entomologist’s Gazette, 29: 165-176. |
| ○ |
Barnard, P.C., 1990. A revised key to the genera and subgenera of British Hemerobiidae. Neuro News (The newsletter of the British Isles Neuroptera Recording Scheme), 5: 3-5. |
| ○ |
Bastero Monserrat, J. J., 1989. Longinos Navás, científico jesuita. Universidad de Zaragoza. Zaragoza. 229 pp. |
| ○ |
Berland, L., 1962. Atlas des Névroptères de France, Belgique, Suisse. Mégaloptères, Raphidioptères, Névroptères Planipennes, Mécoptères, Trichoptères. Nérée Boubée & Cie. Paris. 158 pp. |
| ○ |
Beutel, R. G., Friedrich, F. & Aspöck, U., 2010. The larval head of Nevrorthidae and the phylogeny of Neuroptera (Insecta). Zoological Journal of the Linnean Society, 158: 533-562. http://dx.doi.org/10.1111/j.1096-3642.2009.00560.x |
| ○ |
Bodenheimer, F. S., 1930. Sympherobius (Nefasitus) amicus Nav. in Die Schädlingsfauna Palästinas. Monographien zur angewandten Entomologie, 10: 137-140. |
| ○ |
Bohigas, M. & Sanchez, A., 1917. Catáleg dels insectes del Museu pertanyents als orders: Paraneuroptera-Ephemeroptera-Plecoptera-Neuroptera-Megaloptera-Rhaphidioptera-Embioptera-Mecoptera-Psocoptera-Trichoptera. Anuari - Junta de Ciències Naturals de Barcelona, 2(1): 301-326. |
| ○ |
Bolívar, I., 1878. Insectos colectados por M. Cuní y Martorell en las cercanías de Barcelona. Actas de la Sociedad Española de Historia Natural, 7: 61-64. |
| ○ |
Branco, M., Franco, J. C., Dunkelblum, E., Assael, F., Protasov, A., Ofer, D. & Mendel, Z., 2006a. A common mode of attraction of larvae and adults of insect predators to the sex pheromone of their prey (Hemiptera: Matsucoccidae). Bulletin of Entomological Research, 96: 179-185. http://dx.doi.org/10.1079/BER2005415 |
| ○ |
Branco, M., Lettere, M., Franco, J. C., Binazzi, A. & Jactel, H., 2006b. Kairomonal response of predators to three pine bast scale sex pheromones. Journal of Chemical Ecology, 32: 1577-1586. http://dx.doi.org/10.1007/s10886-006-9071-6 |
| ○ |
Brauer, F., 1852. Versuch einer Gruppirung der Gattungen in der Zunft Planipennia mit besonderer Rücksicht auf die früheren Stände. Stettiner Entomologische Zeitung, 13: 71-77. |
| ○ |
Brauer, F., 1855. Beiträge zur Kenntniss der Verwandlung der Neuropteren. Verhandlungen des Zoologisch-Botanischen Vereins in Wien, 5: 479-484. |
| ○ |
Brauer, F., 1866. Zusätze und Berichtigungen zu Hagen’s Hemerobidarum Synopsis Synonymica und Beschreibung einer neuen Nymphiden-gattung: Myiodactylus osmyloides aus Australien. Verhandlungen der Kaiserlich-Königlichen Zoologisch-Botanischen Gesellschaft in Wien, 16: 983-992. |
| ○ |
Brauer, F., 1868. Verzeichniss der bis jetzt bekannten Neuropteren in Sinne Linné’s. Erster Abschnitt. Verhandlungen der Kaiserlich-Königlichen Zoologisch-Botanischen Gesellschaft in Wien, 18: 359-416, 711-742. |
| ○ |
Brauer, F., 1871. Beiträge zur Kenntniss der Lebensweise und Verwandlung der Neuropteren (Micromus variegatus Fabr., Panorpa communis L., Bittacus italicus Klg. und Bittacus Hagenii Brau.). Verhandlungen der Kaiserlich-Königlichen Zoologisch-Botanischen Gesellschaft in Wien, 21: 107-116. |
| ○ |
Brauer, F., 1876. Die Neuropteren Europas und insbesondere Oesterreichs mit Rücksicht auf ihre geographische Verbreitung. Festschrift zur Feier des fünfundzwanzigjährigen Bestehen Kaiserlich-Koniglichen Zoologisch-Botanischen Gesellschaft in Wien: [263]-300. |
| ○ |
Brauer, F., 1886. Ansichten über die paläozoischen Insekten und deren Deutung. Annalen des K. K. Naturhistorisches Hofmuseums, 1: 87-126. |
| ○ |
Brauer, F. & Löw, F., 1857. Neuroptera austriaca. Die im Erzherzogthum Oesterreich bis jetzt aufgefundenen Neuropteren nach der analytischen Methode zusammengestellt, nebst einer kurzen Charakteristik aller europäischen Neuropteren-Gattungen. C. Gerold’s Sohn. Wien. xxiii + 80 pp. |
| ○ |
Bugg, R. L., 1987. Observations on Insects Associated with a Nectar-bearing Chilean Tree, Quillaja saponaria Molina (Rosaceae). Pan-Pacific Entomologist, 63(1): 60-64. |
| ○ |
Burmeister, H. C. C., 1839. Handbuch der Entomologie. Zweiter Band. Besondere Entomologie. Zweite Abtheilung. Kaukerfe. Gymnognatha. (Zweite Hälfte; vulgo Neuroptera). Theod. Chr. Friedr. Enslin. Berlin. [i]-xii+757-1050 pp. |
| ○ |
Campos, M. & Ramos, P., 1983. Chrisopidos (Neuroptera) capturados en un olivar del sur de España. Neuroptera International, 2: 219-227. |
| ○ |
Canard, M., 1975. Comparison of the reproduction rate of three predators: Chrysopa perla (L.), Boriomyia subnebulosa (Steph.) and Eumicromus angulatus (Steph.) (Neuroptera: Chrysopidae, Hemerobiidae) with respect to the aphid prey. Reports and Informations. Section V: Biological and Genetic Control (Eighth International Plant Protection Congress, Moscow): 50-52. |
| ○ |
Canard, M., 1997. Can lacewings feed on pests in the winter? (Neur: Chrysopidae and Hemerobiidae). Entomophaga, 42: 113-117. http://dx.doi.org/10.1007/BF02769887 |
| ○ |
Canard, M., 2001. Natural food and feeding habits of lacewings. In: P. K. McEwen, T. R. New & A. E. Whittington (eds.). Lacewings in the crop environment. Cambridge University Press. Cambridge: 116-129. |
| ○ |
Canard, M., Grimal, A. & Monserrat, V. J., 1992. A list of green and brown lacewings recently collected in the central Pyrenees (Insecta: Neuroptera: Chrysopidae, Hemerobiidae). In: M. Canard, H. Aspöck & M. W. Mansell (eds.). Current Research in Neuropterology (Proceedings of the Fourth International Symposium on Neuropterology, June 1991, Bagnères-de-Luchon). Toulouse: 95-97. |
| ○ |
Canard, M. & Laudého, Y., 1977. Les Néuroptères capturés au piège de McPhail dans les oliviers en Grèce. 1: l’île d’Aguistri. Biologia Gallo-Hellenica, 7(1-2): 65-75. |
| ○ |
Canard, M., Neverschivander, P. & Michelakis, S., 1979. Les Névroptères capturés au piège de McPhail dans les oliviers in Grèce. 3: La Crète occidentale. Annales de la Société Entomologique de France (N.S.), 15(4): 607-615. |
| ○ |
Canard, M. & Volkovich, T. A., 2001. Outlines of lacewing development. In: P. K. McEwen, T. R. New & A. E. Whittington (eds.). Lacewings in the crop environment. Cambridge University Press. Cambridge: 130-153. |
| ○ |
Carpenter, G. D. H., 1938. Notes on insects collected in West Greenland by the Oxford University Greenland Expedition, 1936. Annals and Magazine of Natural History, (11), 1(5): 529-553. http://dx.doi.org/10.1080/00222933808526799 |
| ○ |
Carpenter, F. M., 1940. A revision of the Nearctic Hemerobiidae, Berothidae, Sisyridae, Polystoechotidae and Dilaridae (Neuroptera). Proceedings of the American Academy of Arts and Sciences, 74: 193-280. http://dx.doi.org/10.2307/20023398 |
| ○ |
Carpenter, F. M., 1961. Insects of Micronesia. Neuroptera: Hemerobiidae. Insects of Micronesia, 8(3): 35-43. |
| ○ |
Carpenter, F. M., 1992. Treatise on Invertebrate Paleontology. Part R. Arthropoda 4. Vols. 3 and 4: Superclass Hexapoda. The Geological Society of America and The University of Kansas. xxi+1-277 [vol. 3], ii+279-655 [vol. 4]. |
| ○ |
Cave, R. D. & Miller, G. L., 1987. Notes on Anacharis melanoneura (Hymenoptera: Figitidae) and Charitopes mellicornis (Hymenoptera: Ichneumonidae) parasitizing Micromus posticus (Neuroptera: Hemerobiidae). Entomological News, 98: 211-216. |
| ○ |
Chapman, J. W., Reynolds, D. R., Smith, A. D., Smith, E. T. & Woiwod, I. P., 2004. An aerial netting study of insects migrating at high altitude over England. Bulletin of Entomological Research, 94: 123-136. http://dx.doi.org/10.1079/BER2004287 |
| ○ |
Codina, A., 1913. Comunicacions. Butlletí de la Institució Catalana d’Història Natural, 13: 98. |
| ○ |
Cole, F. R., 1925. The natural enemies of the citrus aphid, Aphis spiraecola (Patch). Journal of Economic Entomology, 18: 219-223. http://dx.doi.org/10.1093/jee/18.1.219 |
| ○ |
Cole, F. R., 1933. Natural control of the citrus mealybug. Journal of Economic Entomology, 26: 855-864. http://dx.doi.org/10.1093/jee/26.4.855 |
| ○ |
Collins, G. A., 1996. In what stage does Micromus angulatus (Stephens, 1836) (Neur.: Hemerobiidae) overwinter? The Entomologist’s Record and Journal of Variation, 108: 147. |
| ○ |
Compte, A., 1968. Síntesis de la fauna de Menorca, su naturaleza y un ensayo acerca de su origen. Revista de Menorca, 212 pp. |
| ○ |
Comstock, J. H., 1918. The wings of Insects. Comstock. Ithaca. 430 pp. |
| ○ |
Costa, A., 1855. Famiglia degli Emerobiidei – Hemerobiidae. In: A. Costa, 1860-1870. Fauna del Regno di Napoli ossia enumerazione di tutti gli animali che abitano le diverse regioni di questo regno e le acque che le bagnano e descrizione de’ nuovi o poco esattamente conosciuti con figure ricavate da originali viventi e dipinte al naturale. Stamperia di Antonio Cons. Napoli: 22 pp. Para los años de edición de esta obra ver: Sherborn (1937) y/o Pantaleoni (1999). |
| ○ |
Costa, A., 1863. Nuovi studii sulla entomologia della Calabria ulteriore. Atti della Reale Accademia delle Scienze Fisiche e Matematiche di Napoli, (1), 1(2):1-80. |
| ○ |
Cuní y Martorell, M., 1880. Excursión entomológica y botánica a San Miguel de Fay. Anales de la Sociedad Española Historia Natural, 9: 204-242. |
| ○ |
Cuní y Martorell, M., 1888. Insectos observados en los alrededores de Barcelona. Anales de la Sociedad Española Historia Natural, 17: 133-191. |
| ○ |
Cuní y Martorell, M., 1890. Una excursio sense sortir de casa. Henrich. Barcelona. 28 pp. |
| ○ |
Currie, R. P., 1904a. Hemerobiidae from the Kootenay district of British Columbia. Proceedings of the Entomological Society of Washington, 6: 81-90. |
| ○ |
Currie, R. P., 1904b. Notes on some Hemerobiidae from Arizona and California. Proceedings of the Entomological Society of Washington, 6: 79-81. |
| ○ |
Curtis, J., 1854. Descriptions of two species of the genus Hemerobius of Linnaeus, new to this country, with remarks on the nomenclature of Coniopteryx, and on Orthotaenia, Buoliana, & c. Transactions of the Royal Entomological Society of London, 8(3): 56-60. http://dx.doi.org/10.1111/j.1365-2311.1854.tb02660.x |
| ○ |
Curtis, J., 1862. British entomology; being illustrations and descriptions of the genera of insects found in Great Britain and Ireland: containing coloured figures from nature of the most rare and beautiful species, and in many instances of the plants upon which they are found. Vol. 4. Hymenoptera, part 2, Neuroptera. Trichoptera. L. Reeve. London. |
| ○ |
Cutright, C. R., 1923. Life history of Micromus posticus Walker. Journal of Economic Entomology, 16: 448-456. http://dx.doi.org/10.1093/jee/16.5.448 |
| ○ |
Cuvier, G. L. C. F. D., 1817. Le règne animal distribué d’après son organisation, pour servir de base à l’histoire naturelle des animaux et d’introduction a l’anatomie comparée. 4 Vols. Deterville. Paris. |
| ○ |
Daane, K. M., 2001. Ecological studies of released lacewings in crops. In: P. K. McEwen, T. R. New & A. E. Whittington (eds.). Lacewings in the crop environment. Cambridge University Press. Cambridge: 338-350. |
| ○ |
De Geer, C., 1783. Genera et species insectorum e generossimi auctoria scriptis. Lebrecht. Lipsiae. 220 pp. http://dx.doi.org/10.5962/bhl.title.12419 |
| ○ |
De Montmollin, C., 1978. Recherches sur le comportement de ponte de Boriomyia subnebulosa (Stephens) (Neuroptera: Hemerobiidae): choix d’un site de ponte et rythme nycthémeral. Thèse de 3ème cycle, Université Paul-Sabatier. Toulouse. 80 pp. |
| ○ |
Devetak, D., 1998. Detection of substrate vibration in Neuropteroidea: a review. In: S. P. Panelius (ed.). Neuropterology 1997 (Proceedings of the Sixth International Symposium on Neuropterology, July 1997, Helsinki). Acta Zoologica Fennica, 209: 87-94. |
| ○ |
Devetak, D., 2014. Host diversity and seasonality of Hyalospora hemerobii (Apicomplexa: Eugregarinorida: Hirmocystidae) infections in lacewings. Biologia, Section Zoology, 69(11): 1585-1592. http://dx.doi.org/10.2478/s11756-014-0456-7 |
| ○ |
Dey, S. R. & Bhattacharya, D. K., 1997. Development and larval voracity of an aphidophagous predator, Hemerobius indicus Kimmins (Hemerobiidae: Neuroptera) in Garhwal range of Western Himalaya. Journal of Aphidology, 11: 129-131. |
| ○ |
Deyrup, M. & Deyrup, N., 1978. Pupation of Hemerobius in Douglas-fir cones (Neuroptera: Hemerobiidae). Pan-Pacific Entomologist, 54: 143-146. |
| ○ |
Díaz-Aranda, L. M. & Monserrat, V. J., 1988a. Contribución al conocimiento de los neurópteros de Jaén. (Insecta, Neuropteroidea). Boletín de la Asociacion Española de Entomología, 12: 111-123. |
| ○ |
Díaz-Aranda, L. M. & Monserrat, V.J., 1988b. Contribución al conocimiento de los neurópteros de Teruel (Insecta, Neuropteroidea). Boletín de la Asociacion Española de Entomología, 12: 215-231. |
| ○ |
Diaz Aranda L. M. & Monserrat, V. J., 1988c. Contribución al conocimiento de los Neurópteros de Granada (Insecta, Neuropteroiea). Actas III Congreso Ibérico de Entomología, Granada: 211-227. |
| ○ |
Díaz-Aranda, L.M., Monserrat, V. J. & Marín, F., 1986a. Composición biogeográfica de los neurópteros de Guadalajara (Insecta, Neuropteroidea: Planipennia). Actas VIII Jornadas de la Asociación Española de Entomología, Sevilla: 1121-1130. |
| ○ |
Díaz-Aranda, L.M., Monserrat, V. J. & Marín, F., 1986b. Contribución al conocimiento de los neurópteros de Guadalajara (Insecta, Neuropteroidea). Actas VIII Jornadas de la Asociación Española de Entomología, Sevilla: 1131-1141. |
| ○ |
Dobosz, R., 1993. Megalomus andreini Navás, 1928, a new synonym of M. pyraloides Rambur, 1842 (Neuroptera: Hemerobiidae). Rocznik Muzeum Górnoslaskiego w Bytomiu, Entomologia, 4: 169-171. |
| ○ |
Duelli, P., 1984. Dispersal and oviposition strategies in Chrysoperla carnea. In: J. Gepp, H. Aspöck & H. Hölzel (eds.). Progress in World’s Neuropterology (Proceedings of the 1st International Symposium on Neuropterology, September 1980, Graz). Graz: 133-145. |
| ○ |
Duelli, P., 1986. A “missing link” in the evolution of the egg pedicel in lacewings? Experientia, 42:624. http://dx.doi.org/10.1007/BF01955564 |
| ○ |
Duelli, P., 2001. Lacewings in field crops. In: P. K. McEwen, T. R. New & A. E. Whittington (eds.). Lacewings in the crop environment. Cambridge University Press. Cambridge: 158-171. |
| ○ |
Duelli, P., Obrist, M. K. & Flückiger, P. F., 2002. Forest edges are biodiversity hotspots – also for Neuroptera. Acta Zoologica Academiae Scientiarum Hungaricae, 48(Suppl. 2): 75-87. |
| ○ |
Dujardin, F., 1851. Sur une larve qui paraît être celle de l’Hemerobius hirtus. Annales des Sciences Naturelles, Zoologie et Biologie Animale, (3), 15: 169-173. |
| ○ |
Dunn, J. A., 1954. Micromus variegatus Fabricius (Neuroptera) as a predator of the Pea Aphid. Proceedings of the Royal Entomological Society of London, Series A, General Entomology, 29: 76-80. http://dx.doi.org/10.1111/j.1365-3032.1954.tb01202.x |
| ○ |
Dziędzielewicz, J., 1891. Przeglad fauny krajowej Owadow Siatkoskrzydlych (Neuroptera, Pseudoneuroptera). Sprawozdanie Komisji Fizjograficznej, 26: 26-150. |
| ○ |
Eglin, W., 1941. Beitrag zur Kenntnis der Neuropteroidea des Wallis. Bulletin de la Murithienne, 58: 63-95. |
| ○ |
Engel, M. S. & Grimaldi, D. A., 2007. The neuropterid fauna of Dominican and Mexican amber (Neuropterida: Megaloptera, Neuroptera). American Museum Novitates, 3587: 1-58. http://dx.doi.org/10.1206/0003-0082(2007)3587%5B1:TNFODA%5D2.0.CO;2 |
| ○ |
Engel, M. S. & Grimaldi, D. A., 2008. Diverse Neuropterida in Cretaceous amber, with particular reference to the paleofauna of Myanmar (Insecta). Nova Supplementa Entomologica, 20: 1-86. |
| ○ |
Esben-Petersen, P., 1914. Descriptions of a new genus and some new or interesting species of Planipennia. Notes from the Leyden Museum, 36: 263-270. |
| ○ |
Esben-Petersen, P., 1920a. Neuropteren der inneren Sahara (Aus der sammelausbeute des Freiherrn Hans von Geyr). Archiv für Naturgeschichte, (A), 84(9): 143-159. |
| ○ |
Esben-Petersen, P., 1920b. South African Neuroptera. I. Annals of the South African Museum, 17: 507-521. |
| ○ |
Esben-Petersen, P., 1921. Notes concerning some Neuroptera in the Helsingfors Museum together with a description of Hemerobius poppii. Notulae Entomologicae, 1: 38-43. |
| ○ |
Esben-Petersen, P., 1924. More Neuroptera from Juan Fernandez and Easter Island. In: C. Skottsberg (ed.). The Natural History of Juan Fernandez and Easter Island. Vol. 3 (Zoology), Part III. Almqvist and Wiksells Boktryckeri. Uppsala: 309-313. |
| ○ |
Esben-Petersen, P., 1928a. Neuroptera. In: Insects of Samoa and other Samoan terrestrial Arthropoda, Fasc. 3, Part VII. British Museum of Natural History. London: 89-108. |
| ○ |
Esben-Petersen, P., 1928b. Neuroptera and Embiidina from Abyssinia and Somaliland. Annals and Magazine of Natural History, (10), 1: 442-450. http://dx.doi.org/10.1080/00222932808672808 |
| ○ |
Esben-Petersen, P., 1931. Inventa entomologica itineris Hispanici et Maroccani, quod a. 1926 fecerunt Harald et Håkan Lindberg. VIII. Neuroptera. Commentationes Biologicae, 3(13): 1-6. |
| ○ |
Esben-Petersen, P., 1935. Neuroptera from the Society Islands, in Marquesan Insects III. Bulletin of the Bernice Pauahi Bishop Museum, 142: 137-142. |
| ○ |
Esben-Petersen, P., 1936. Neuroptera from the Canary Islands. Commentationes Biologicae, 6(6): 1-5. |
| ○ |
Esben-Petersen, P., 1937. Check list of Neuroptera Planipennia of Oceania. Occasional Papers of the Bernice Pauahi Bishop Museum, 13: 49-60. |
| ○ |
Essig, E. O., 1910. The natural enemies of the citrus mealybug. I. Pomona College Journal of Entomology and Zoology, 2: 143-146. |
| ○ |
Fabricius, J. C., 1777. Genera insectorvm eorvmqve characteres natvrales secvndvm nvmervm, figvram, sitvm et proportionem omnivm partivm oris adiecta mantissa speciervm nvper detectarvm. M. F. Bartsch. Chilonii. 310 pp. |
| ○ |
Fabricius, J. C., 1781. Species insectorvm exhibentes eorvm differentias specificas, synonyma avctorvm, loca natalia, metamorphosin adiectis observationibvs, descriptionibvs. Tome 1. C. E. Bohnii. Hamburgi et Kilonii. 552 pp. |
| ○ |
Fabricius, J. C., 1793. Entomologia systematica emendata et aucta secundum classes, ordines, genera, species adjectis synonimis, locis observationibus, descriptionibus. Tome 2. C. G. Proft. Hafniae. 519 pp. |
| ○ |
Faúndez, E., 2005. Asociación críptica de Gayomyia falcata (Blanchard, 1851) (Neuroptera: Hemerobiidae) con la zarzapirrilla Ribes magellanicum Poiret, 1812 (Saxifragaceae) en la región de Magallanes. Anales del Instituto de la Patagonia, Serie Ciencias Naturales, 33: 63-64. |
| ○ |
Forsius, R., 1924. On Ceratopogoninae as ectoparasites on Neuroptera. Notulae Entomologicae, 4: 98-99. |
| ○ |
Frankenberg, G. V., 1937. Aufzucht von Blattlauslöwen der Gattung Boriomya. Der Naturforscher, 14: 183-186. |
| ○ |
Fraser, F. C., 1940. Biological notes on Eumicromus angulatus (Stephens) and description of larva (Neur.). Journal of the Society for British Entomology, 2: 69-71. |
| ○ |
Fraser, F. C., 1942. A new species of Kimminsia (Neur. Hemerobiidae), with historical figures and notes by R. McLachlan and K. J. Morton. The Entomologist’s Monthly Magazine, 78: 80-86. |
| ○ |
Fraser, F. C., 1951. A revision of the Madagascar Neuroptera with a key to their identifications and descriptions of new species. I. Osmylidae, Hemerobiidae and Chrysopidae. Naturaliste Malgache, 3: 15-31. |
| ○ |
Fraser, F. C., 1955. Nouvelles notes sur les Nevropteres de Madagascar. Naturaliste Malgache, 7: 127-137. |
| ○ |
Fraser, F. C., 1957. Odonata and Neuroptera of Reunion. Mémoires de l’Institut Scientifique de Madagascar, (E), 8: 15-28. |
| ○ |
Fulmek, L., 1941. Über die Aufzucht von Drepanepteryx phalaenoides L. ex ovo. (Neuroptera: Planipennia, Hemerobiidae). Arbeiten uber Morphologische und Taxonomische Entomologie, 8: 127-130. |
| ○ |
Garcia, A., Figueiredo, E., Valente, C., Monserrat, V. J. & Branco, M., 2013. First record of Thaumastocoris peregrinus in Western Europe and of the neotropical predator Hemerobius bolivari in Europe. Bulletin of Insectology, 66(2): 251-256. |
| ○ |
Garland, J. A., 1978. Observations on survival of eggs of Hemerobius stigma (Neuroptera: Hemerobiidae) following exposure to frost. Manitoba Entomologist, 12: 61-62. |
| ○ |
Garland, J. A., 1980. Effect of low-temperature storage on oviposition in Hemerobius stigma Steph. (Neuroptera, Hemerobiidae). The Entomologist’s Monthly Magazine, 116: 149-150. |
| ○ |
Gaumont, J., 1976. L’appareil digestif des larves de Planipennes. Annales des Sciences Naturelles, Zoologie et Biologie Animale, 18: 145-250. |
| ○ |
Geoffroy, É. L., 1762. Histoire abregée des insectes qui se trouvent aux environs de Paris; dans laquelle ces animaux sont rangés suivant un ordre méthodique. Vol. 2. Durand. Paris. 690 pp. http://dx.doi.org/10.5962/bhl.title.14710 |
| ○ |
Gepp, J., 1977. Die Planipennier der Steiermark (Neuroptera s. str., Neuropteroidea, Insecta): Autökologie und Regionalfaunistik. Mitteilungen des Naturwissenschaftlichen Vereins für Steiermark, 107: 171-206. |
| ○ |
Gepp, J., 1981. Rote Liste der gefährdeten Netzflüglerarten der Steiermark (Megaloptera, Raphidioptera und Planipennia). Steirischer Naturschutzbrief, Sonderheft, 3: 91-96. |
| ○ |
Gepp, J., 1983. Rote Liste der gefährdeten Netzflügler Österreichs (Megaloptera, Raphidioptera und Planipennia). In: Rote Listen gefährdeter Tiere Österreichs. Bundesministeriums für Gesundheit und Umweltschutz. Wein: 145-147. |
| ○ |
Gepp, J., 1984. Erforschungsstand der Neuropteren-Larven der Erde (mit einem Schlüssel zur larvaldiagnose der Familien, einer Übersicht von 340 beschreibenen Larven und 600 Literaturzitaten). In: J. Gepp, H. Aspöck & H. Hölzel (eds.). Progress in World’s Neuropterology (Proceedings of the 1st International Symposium on Neuropterology, September 1980, Graz). Graz: 183-239. |
| ○ |
Gepp, J., 1986. Biology and larval diagnosis of central European Neuroptera (a review of present knowledge). In: J. Gepp, H. Aspöck & H. Hölzel (eds.). Recent Research in Neuropterology (Proceedings of the 2nd International Symposium on Neuropterology, August 1984, Hamburg). Graz: 137-144. |
| ○ |
Gepp, J., 1990. An illustrated review of egg morphology in the families of Neuroptera (Insecta: Neuropteroidea). In: M. W. Mansell & H. Aspöck (eds.). Advances in Neuropterology (Proceedings of the Third International Symposium on Neuropterology, February 1988, Berg en Dal). South African Department of Agricultural Development. Pretoria: 131-149. |
| ○ |
Gepp, J., 1999. Neuropteren als Indikatoren der Naturraumbewertung. Eignung als Modellgruppe, Methodenwahl, Fallbeispiele sowie Diskussion möglicher Fragestellungen (Neuropterida). Stapfia, 60: 167-208. |
| ○ |
Geus, A., 1969. Sporentierchen, Sporozoa: die Gregarinida der land- und süßwasserbewohnenden Arthropoden Mitteleuropas. In: F. Dahl (ed.). Die Tierwelt Deutschlands und der angrezenden Meeresteile nach ihren Merkmalen und nach ihrer Lebensweise, T. 57. Gustav Fischer. Jena. 608 pp. |
| ○ |
Ghosh, S. K., 1976. Hemerobius solanensis n. sp. from India (Neuroptera: Hemerobiidae). Entomologica Scandinavica, 7: 75. http://dx.doi.org/10.1163/187631276X00135 |
| ○ |
Ghosh, S. K., 1977. A new genus and a new species of Neuroptera (Fam. Hamerobiidae [sic]) from India. Proceedings of the Indian Academy of Sciences, (B), 86: 235-237. |
| ○ |
Ghosh, S. K., 1990. A new genus and a new species of the family Hemerobiidae (Neuroptera) from India. Records of the Zoological Survey of India, 87: 61-63. |
| ○ |
González Olazo, E. V., 1981. El genero Megalomus Rambur (Neurop.-Hemerobiidae) en Argentina y Chile. Acta Zoologica Lilloana, 36: 97-113. |
| ○ |
González Olazo, E. V., 1987a. Notas sinonimicas sobre Anotiobiella withycombei Kimmins, 1929 (Neuroptera, Hemerobiidae). Acta Zoologica Lilloana, 39: 43-45. |
| ○ |
González Olazo, E. V., 1987b. Una nueva especie de Megalomus (Neuroptera, Hemerobiidae) del Peru. Acta Zoologica Lilloana, 39: 95-96. |
| ○ |
González Olazo, E. V., 1992a. Sobre dos nuevos generos australes de Hemerobiidae (Neuroptera, Planipennia). Acta Zoologica Lilloana, 42: 149-154. |
| ○ |
González Olazo, E. V., 1992b. Una nueva especie de Nomerobius (Neuroptera, Hemerobiidae) de la Argentina. Acta Zoologica Lilloana, 42: 109-111. |
| ○ |
González Olazo, E. V., 1992c. Contribucion al conocimiento del genero Pirioius [sic] Navas, 1928 (Neuroptera, Planipennia). Acta Zoologica Lilloana, 42: 155-164. |
| ○ |
González Olazo, E. V., 1993. Contribucion al conocimiento de las especies de Nusalala (Neuroptera, Planipennia, Hemerobiidae) de la Argentina. Acta Zoologica Lilloana, 42: 215-224. |
| ○ |
Greve, L., 1969. An aerial-drift of Neuroptera from Hardangervidda, western Norway. Årbok for Universitetet i Bergen, Matematisk-Naturvitenskapelig Serie, 2: 1-15. |
| ○ |
Greve, L., 1978. Notes on Wesmaelius ravus (Withycombe, 1923) and Wesmaelius mortoni (McL. 1899) (Neuroptera, Planipennia) in Norway. Norwegian Journal of Entomology, 25: 223-224. |
| ○ |
Greve, L., 1984. Distribution of the genus Wesmaelius Krüger in Norway. In: J. Gepp, H. Aspöck & H. Hölzel (eds.). Progress in World’s Neuropterology (Proceedings of the 1st International Symposium on Neuropterology, September 1980, Graz). Graz: 71-74. |
| ○ |
Greve, L. & Kobro, S., 1998. Preliminary data on abundance of phototactic Neuroptera and Rephidioptera in SE Norway as indicated by light-trap catches. In: S. P. Panelius (ed.). Neuropterology 1997 (Proceedings of the Sixth International Symposium on Neuropterology, July 1997, Helsinki). Acta Zoologica Fennica, 209: 119-120. |
| ○ |
Greve, L. & Kobro, S., 2009. Abundance of Micromus variegatus (Fabricius, 1793) (Neuroptera, Hemerobiidae) in SE Norway as indicated by light-trap catches. Norwegian Journal of Entomology, 56: 140-142. |
| ○ |
Grimaldi, D., 2000. A diverse fauna of Neuropterodea in amber from the Cretaceous of New Jersey. In: D. Grimaldi (ed.). Studies on fossils in amber, with particular reference to the Cretaceous of New Jersey. Backhuys. Leiden: 259-303. |
| ○ |
Grimaldi, D. A. & Engel, M. S., 2005. Evolution of the Insects. Cambridge University Press. New York. xv+755 pp. |
| ○ |
Grimaldi, D. A., Engel, M. S. & Nascimbene, P. C., 2002. Fossiliferous Cretaceous amber from Myanmar (Burma): its rediscovery, biotic diversity, and peleontological significance. American Museum Novitates, 3361: 1-72. http://dx.doi.org/10.1206/0003-0082(2002)361%3C0001:FCAFMB%3E2.0.CO;2 |
| ○ |
Gruppe, A. V., 2007. Ungewöhnliche Funde von Neuropteren. DGaaE Nachrichten, 21: 141-142. |
| ○ |
Günther, K. K., 1991. Echte Netzflügler aus Lichtfängen im Stadtgebiet von Berlin (Insecta, Neuroptera). Entomologische Nachrichten und Berichte, 35: 161-170. |
| ○ |
Gurney, A. B., 1948. Notes on Nearctic Hemerobiidae, with descriptions of two new species (Neuroptera). Annals of the Entomological Society of America, 41: 213-222. http://dx.doi.org/10.1093/aesa/41.2.213 |
| ○ |
Hagen, H. A., 1850. Uebersicht der neueren Literatur, betreffend die Neuroptera Linn. Stettiner Entomologische Zeitung, 11: 67-83, 362-378. |
| ○ |
Hagen, H. A., 1851. Uebersicht der neueren Literatur, betreffend die Neuroptera Linn. Stettiner Entomologische Zeitung, 12: 118-128, 185-191, 345-350, 365-375. |
| ○ |
Hagen, H. A., 1854. Ueber die Neuropteren der Bernsteinfauna. Verhandlungen des Zoologisch-Botanischen Vereins in Wien, 4: 221-232. |
| ○ |
Hagen, H. A., 1856. Die im Bernstein befindlichen Neuropteren der vorwelt bearbeitet von F. J. Pictet-Baraban, und Dr. H. Hagen. In: G. C. Berendt (ed.). Die im Bernstein befindlichen organischen reste der Vorwelt gesammelt, in verbindung mit mehreren bearbeitet und herausgegeben von Dr. Georg Carl Berendt, Bande 2. Nicholaischen Buchhandlung. Berlin: 41-125. |
| ○ |
Hagen, H. A., 1858. Synopsis of the British Planipennes. Entomologist’s Annual, 1858: 17-33. |
| ○ |
Hagen, H. A., 1859. Synopsis der Neuroptera Ceylons (Pars II.). Verhandlungen der Kaiserlich-Königlichen Zoologisch-Botanischen Gesellschaft in Wien, 9: 199-212. |
| ○ |
Hagen, H. A., 1861. Synopsis of the Neuroptera of North America, with a list of the South American species. Smithsonian Miscellaneous Collections, 4(1): xx+1-347. http://dx.doi.org/10.5962/bhl.title.60275 |
| ○ |
Hagen, H. A., 1862. Neuroptera. Netzflügler. In: W. C. H. Peters (ed.). Naturwissenschaftliche Reise nach Mossambique. Vol. 5 (Insecten und Myriopoden). Reimer. Berlin: 57-105. |
| ○ |
Hagen, H. A., 1866a. Hemerobidarum Synopsis synonymica. Stettiner Entomologische Zeitung, 27: 369-462. |
| ○ |
Hagen, H. A., 1886b. Monograph of the Hemerobiidae. Part II. Proceedings of the Boston Society of Natural History, 23: 276-292. |
| ○ |
Hagen, H. A., 1866c. Die Neuropteren Spaniens nach Ed. Pictet’s Synopsis des Neuroptères d’Espagne. Genève 1865. 8. tab. 14 col. und Dr. Staudingers Mittheilungen. Stettiner Entomologische Zeitung, 27: 281-302. |
| ○ |
Hagen, H. A., 1888. Three species of Hemerobius from Chili. Proceedings of the Boston Society of Natural History, 23: 565-566. |
| ○ |
Handlirsch, A., 1906-1908. Die fossilen Insekten und die Phylogenie der rezenten Formen. W. Engelmann. Leipzig. 1430 pp. |
| ○ |
Handschin, E., 1955. Los insectos de las Islas Juan Fernández. 15. Neuroptera. Revista Chilena de Entomología, 4: 3-20. |
| ○ |
Hardy, A. C. & Cheng, L., 1986. Studies in the distribution of insects by aerial currents. III. Insect drift over the sea. Ecological Entomology, 11: 283-290. http://dx.doi.org/10.1111/j.1365-2311.1986.tb00304.x |
| ○ |
Haring, E. & Aspöck, U., 2004. Phylogeny of the Neuropterida: a first molecular approach. Systematic Entomology, 29: 415-430. http://dx.doi.org/10.1111/j.0307-6970.2004.00263.x |
| ○ |
Haring, E., Aspöck, H., Bartel, D. & Aspöck, U., 2011. Molecular phylogeny of the Raphidiidae (Raphidioptera). Systematic Entomology, 36: 16-30. http://dx.doi.org/10.1111/j.1365-3113.2010.00542.x |
| ○ |
Henriksen, K. L., 1922. Eocene Insects from Denmark. Danmarks Geologiske Undersogelse, 2(37): 1-36. |
| ○ |
Henry, C. S., Penny, N. D. & Adams, P. A., 1992. The neuropteroid orders of Central America (Neuroptera and Megaloptera). In: D. Quintero & A. Aiello (eds.). Insects of Panama and Mesoamerica: selected studies. Oxford University Press. Oxford: 432-458. |
| ○ |
Hinke, F., 1975. Autökologische Untersuchungen an mitteleuropäischen Neuropteren. Zoologische Jahrbücher. Abteilung für Systematik, Geographie und Biologie, 102: 303-330. |
| ○ |
Hollier, J. A. & Belshaw, R. D., 1993. Stratification and phenology of a woodland Neuroptera assemblage. The Entomologist, 112:169-175. |
| ○ |
Hollier, J. A., Smith, P. H. D. & Mortimer, S., 1997. Habitat use and wing form in Psectra diptera (Neuroptera: Hemerobiidae). The Entomologist, 116: 28-30. |
| ○ |
Hölzel, H., 1963. Bemerkungen zu Boriomyia-Arten (Neuropt., Planipennia). Nachrichtenblatt der Bayerischen Entomologen, 12: 6-7. |
| ○ |
Hölzel, H., 1964. Die Netzflügler Kärntens. Carinthia, 2: 97-156. |
| ○ |
Hölzel, H., 1970. Ein neuer Hemerobius aus Mitteleuropa (Planipennia, Hemerobiidae). Nachrichtenblatt der Bayerischen Entomologen, 18: 104-106. |
| ○ |
Hölzel, H., 1973. Neuropteren aus Korea (Hemerobiidae und Chrysopidae). Rovartani Közlemények, (N.S.), 26(Supp.): 83-90. |
| ○ |
Hölzel, H., 1988. Neuroptera of Arabia: Fam. Sisyridae, Hemerobiidae, Chrysopidae (Part 2) and Myrmeleonidae (Part 3). Fauna of Saudi Arabia, 9: 52-67. |
| ○ |
Hölzel, H., 1995. Beitrag zur Kenntnis der Neuropteren der Arabischen Halbinsel. I. Chrysopidae und Hemerobiidae von Oman und Yemen (Neuroptera: Chrysopidae, Hemerobiidae). Entomofauna, 16: 437-452. |
| ○ |
Hölzel, H., 2002. Neuroptera collected by the German Yemen expeditions 1996, 1998 und 2000 (Neuroptera: Chrysopidae, Hemerobiidae, Berothidae, Mantispidae, Nemopteridae, Myrmeleontidae, Ascalaphidae). Esperiana, 9: 129-146. |
| ○ |
Hölzel, H., 2007. Hemerobiidae of the Afrotropical region: A review of current knowledge. Annali del Museo civico di Storia Naturale Ferrara, 5: 1-10. |
| ○ |
Honěk, A. & Kocourek, F., 1986. The flight of aphid predators to a light trap: possible interpretations. In: I. Hodek (ed.). Ecology of Aphidophaga. Academia. Praha: 333-338. |
| ○ |
Horne, P. A., Ridland, P. M. & New, T. R., 2001. Micromus tasmaniae: a key predator on aphids on field crops in Australasia? In: P. K. McEwen, T. R. New & A. E. Whittington (eds.). Lacewings in the crop environment. Cambridge University Press. Cambridge: 388-394. |
| ○ |
Horton, D. R., Broers, D. A., Hinojosa, T., Lewis, T. M., Miliczky, E. R. & Lewis, R. R., 2002. Diversity and phenology of predatory arthropods overwintering in cardboard bands placed in pear and apple orchards of central Washington State. Annals of the Entomological Society of America, 95: 469-480. http://dx.doi.org/10.1603/0013-8746(2002)095%5B0469:DAPOPA%5D2.0.CO;2 |
| ○ |
Howard, L. O., 1891. The parasites of the Hemerobiinae. Proceedings of the Entomological Society of Washington, 2: 123-124. |
| ○ |
Hussein, M. Y., 1984. Nutritional requirements for reproduction of Micromus tasmaniae Walker (Neuroptera: Hemerobiidae). Pertanika, 7: 115-117. |
| ○ |
Hussein, M. Y., 1985. Prey selection by larval Micromus tasmaniae Walker, (Neuroptera: Hemerobiidae). Pertanika, 8: 359-363. |
| ○ |
Jarzembowski, E. A., 1980. Fossil insects from the Bembridge Marls, Palaeogene of the Isle of Wight, southern England. Bulletin of the British Museum of Natural History, Geology, 33: 237-293. |
| ○ |
Jepson, J. E., Makarkin, V. N. & Coramc, R. A., 2012. Lacewings (Insecta: Neuroptera) from the Lower Cretaceous Purbeck Limestone. Group of southern England. Cretaceous Research, 34: 31-47. http://dx.doi.org/10.1016/j.cretres.2011.10.001 |
| ○ |
Jepson, J. E. & Penney, D., 2007. Neuropteran (Insecta) palaeodiversity with predictions for the Cretaceous fauna of the Wealden. Palaeogeography, Palaeoclimatology, Palaeoecology, 248: 109-118. http://dx.doi.org/10.1016/j.palaeo.2006.11.015 |
| ○ |
Jepson, J. E., Penney, D. & Green, D. I., 2010. A new species of brown lacewing (Neuroptera: Hemerobiidae) from Eocene Baltic amber. Zootaxa, 2692: 61-68. |
| ○ |
Kaisila, J., 1952. Insects from arctic mountain snows. Soumen Hyönteistieteellinen Aikakauskirja, 18, 1: 8-25. |
| ○ |
Kawashima, K., 1958. Bionomics and earlier stages of some Japanese Neuroptera (II) Eumicromus numerosus (Navás) (Hemerobiidae). Mushi, 32: 43-46. |
| ○ |
Kevan, D. K. McE. & Klimaszewski, J., 1986. Notes on the Hemerobiidae or brown lacewings flies (Neuroptera) of Canada and Alaska. Neuroptera International, 4: 7-22. |
| ○ |
Kevan, D. K. McE. & Klimaszewski, J., 1987. The Hemerobiidae of Canada and Alaska. Genus Hemerobius L. Giornale Italiano di Entomologia, 16: 305-369. |
| ○ |
Killington, F. J., 1929. A synopsis of British Neuroptera. Transactions of the Entomological Society of Hampshire and the South of England, 5: 1-36. |
| ○ |
Killington, F. J., 1931. Notes on the life-history of Sympherobius fuscescens Wall. (=inconspicuus McL.) [Neuroptera]. The Entomologist, 64: 217-223. |
| ○ |
Killington, F. J., 1932a. Predacious insects as enemies of Neuroptera. Journal of the Entomological Society of the South of England, 1: 31-33. |
| ○ |
Killington, F. J., 1932b. The life history of Hemerobius simulans Walker (= orotypus Wall.) (Neuroptera, Hemerobiidae). The Entomologist’s Monthly Magazine, 68: 176-180. |
| ○ |
Killington, F. J., 1932c. The life-history of Hemerobius atrifrons McLach. [Neuroptera]. The Entomologist, 65: 201-203. |
| ○ |
Killington, F. J., 1932d. The parasites of Neuroptera with special reference to those attacking British species. Transactions of the Entomological Society of the South of England, 8: 84-91. |
| ○ |
Killington, F. J., 1932e. Web-making spiders as enemies of Neuroptera. Journal of the Entomological Society of the South of England, 1: 29-31. |
| ○ |
Killington, F. J., 1932f. Hymenopterous parasites bred from larvae of Hemerobiidae (Neuroptera). Journal of the Entomological Society of the South of England, 1: 7-8. |
| ○ |
Killington, F. J., 1932g. Notes on the life-history of Hemerobius pini Steph. (Neuroptera). Transactions of the Entomological Society of the South of England, 8: 41-44. |
| ○ |
Killington, F. J., 1932h. Neuroptera as the prey of bats. Journal of the Entomological Society of the South of England, 1: 28-29. |
| ○ |
Killington, F. J., 1933. A new species of Boriomyia (Neur., Hemerobiidae) from France. The Entomologist’s Monthly Magazine, 69: 57-59. |
| ○ |
Killington, F. J., 1934a. Hymenopterous parasites bred from Hemerobiidae (Neur.) in 1933. Journal of the Society for British Entomology, 1: 6-7. |
| ○ |
Killington, F. J., 1934b. On the life-histories of some British Hemerobiidae (Neur.). Transactions of the Society for British Entomology, 1 (2): 119-134. |
| ○ |
Killington, F. J., 1934c. On the identity of Hemerobius limbatellus of British authors; with a revised key to the British species of Hemerobius (Neur.). Transactions of the Society for British Entomology, 1: 33-38. |
| ○ |
Killington, F. J., 1935. Remarks on the name of Boriomyia betulina (Strom) (= Hemerobius nervosus Fabr.) (Neur.): a reply to Mr. K. J. Morton. The Entomologist’s Monthly Magazine, 71: 188-194. |
| ○ |
Killington, F. J., 1936. A monograph of the British Neuroptera. Vol. 1. Ray Society. London. xix+269 pp. |
| ○ |
Killington, F. J., 1937. A monograph of the British Neuroptera. Vol. 2. Ray Society. London. xii+306 pp. |
| ○ |
Killington, F. J., 1946. On Psectra diptera (Burm.) (Neur., Hemerobiidae), including an account of its life-history. The Entomologist’s Monthly Magazine, 82: 161-176. |
| ○ |
Killington, F. J. & Kimmins, D. E., 1932. On the male genital structure of Psectra diptera Burm. (Neur.), with some remarks on the wing venation. The Entomologist’s Monthly Magazine, 68: 153-156. |
| ○ |
Kim, S.-k. & Cho, S.-w., 2011. Taxonomic notes on the species of Hemerobiidae (Neuroptera) of Korea. Korean Journal of Applied Entomology, 50: 65-69. http://dx.doi.org/10.5656/KSAE.2011.03.0.008 |
| ○ |
Kimmins, D. E., 1928. New and little known Neuroptera of Central America. Eos, 4: 363-370. |
| ○ |
Kimmins, D. E., 1929a. Some new and little known Argentine Neuroptera. Revista de la Sociedad Entomológica Argentina, 2: 187-192. |
| ○ |
Kimmins, D. E., 1929b. Two new African hemerobiids (Neuroptera). Annals and Magazine of Natural History, (10), 3: 126-128. http://dx.doi.org/10.1080/00222932908672944 |
| ○ |
Kimmins, D. E., 1931. Notes on the Life-History of Sympherobius fuscescens Wall. (=inconspicuus McL.) (Neuroptera). The Entomologist, 64: 217-223. |
| ○ |
Kimmins, D. E., 1932. Two new Hemerobiidae (Neuroptera). The Entomologist, 65: 160-162. |
| ○ |
Kimmins, D. E., 1933. New species of Notiobiella, from Africa and Seychelles (Neuroptera, Hemerobiidae). The Entomologist, 66: 130-133. |
| ○ |
Kimmins, D. E., 1935a. Notes on the genera Megalomus Rambur and Nesobiella, gen. nov. (Neuroptera), with descriptions of new species. Annals and Magazine of Natural History, (10), 16: 602-619. http://dx.doi.org/10.1080/00222933508655089 |
| ○ |
Kimmins, D. E., 1935b. Some new South African Neuroptera. Annals and Magazine of Natural History, (10), 15: 561-579. http://dx.doi.org/10.1080/00222933508655001 |
| ○ |
Kimmins, D. E., 1936. Two new African Hemerobiidae (Neuroptera). Annals and Magazine of Natural History, (10), 17: 153-158. http://dx.doi.org/10.1080/03745481.1936.10801397 |
| ○ |
Kimmins, D. E., 1937. New species of Nusalala (Neuroptera, Hemerobiidae). Annals and Magazine of Natural History, (10), 17: 568-576. http://dx.doi.org/10.1080/00222933608655156 |
| ○ |
Kimmins, D. E., 1938. New species of Neuroptera. Annals and Magazine of Natural History, (11), 2: 305-311. http://dx.doi.org/10.1080/00222933808526849 |
| ○ |
Kimmins, D. E., 1939a. Supplementary notes on the life-history of Micromus variegatus (Fab.) (Neur.). Journal of the Society for British Entomology, 1: 239-240. |
| ○ |
Kimmins, D. E., 1939b. Ephemeroptera and Neuroptera. In: Ruwenzori Expedition, 1934-5. Vol. 3. British Museum (Natural History). London: 107-115. |
| ○ |
Kimmins, D. E., 1940. New genera and species of Hemerobiidae (Neuroptera). Annals and Magazine of Natural History, (11), 6: 222-236. http://dx.doi.org/10.1080/03745481.1940.9723671 |
| ○ |
Kimmins, D. E., 1943. New species of the genus Neuronema McL. (Neuroptera, Hemerobiidae). Annals and Magazine of Natural History, (11), 10: 40-53. http://dx.doi.org/10.1080/00222934308527316 |
| ○ |
Kimmins, D. E., 1956. A new species of Micromus (Neuroptera, Hemerobiidae). Revue de Zoologie et de Botanique Africaines, 53: 114-117. |
| ○ |
Kimmins, D. E., 1958. Miss L. E. Cheesman’s expedition to New Hebrides, 1955. Orders Odonata, Neuroptera and Trichoptera. Bulletin of the British Museum of Natural History, Entomology, 6: 239-250. |
| ○ |
Kimmins, D. E., 1959. Ephemeroptera, Plecoptera and Neuroptera. In: Ruwenzori Expedition, 1952. Vol. 2. British Museum (Natural History). London: 63-67. |
| ○ |
Kimmins, D. E., 1960. Two new species of Hemerobiidae (Order Neuroptera) from Pakistan. Annals and Magazine of Natural History, (13)3: 337-342. http://dx.doi.org/10.1080/00222936008655776 |
| ○ |
Kimmins, D. E., 1963. Notes on two British species of Neuroptera (Boriomyia mortoni (McL.) and B. killingtoni (Morton), with a description of a new species of the mortoni group of Boriomyia. Entomologist’s Gazette, 14: 140-149. |
| ○ |
King, J. J. F. X. & Halbert, J. N., 1910. A list of the Neuroptera of Ireland. Proceedings of the Royal Irish Academy, 28B(2): 29-112. |
| ○ |
Kis, B., 1965. Eine neue Sympherobius-Art aus Rumänien (Neuroptera, Hemerobiidae). Reichenbachia, 6: 103-106. |
| ○ |
Kis, B., 1968. Zur Kenntnis der Boriomyia-Arten Rumäniens (Neuroptera, Hemerobiidae). Reichenbachia, 10: 207-209. |
| ○ |
Klimaszewski, J. & Kevan, D. K. McE., 1985. The brown lacewing flies of Canada and Alaska (Neuroptera: Hemerobiidae). Part I. The Genus Hemerobius Linnaeus: systematics, bionomics and distribution. Memoire (Lyman Entomological Museum and Research Laboratory), 15: iv+1-119. |
| ○ |
Klimaszewski, J. & Kevan, D. K. McE., 1987a. The brown lacewing flies of Canada and Alaska (Neuroptera; Hemerobiidae). Part II a. The genus Wesmaelius Krüger. Neuroptera International, 4: 153-204. |
| ○ |
Klimaszewski, J. & Kevan, D. K. McE., 1987b. The brown lacewing flies of Canada and Alaska (Neuroptera; Hemerobiidae). Part II b. The genus Wesmaelius Krüger. Neuroptera International, 4: 245-274. |
| ○ |
Klimaszewski, J. & Kevan, D. K. McE., 1988a. New distribution data for Canadian Hemerobiidae (Neuroptera): Genera: Hemerobius Linnaeus, Micromus Rambur and Wesmaelius Kruger. Supplement [1st]. Revue d’Entomologie du Québec, 32: 9-15. |
| ○ |
Klimaszewski, J. & Kevan, D. K. McE., 1988b. The brown lacewing flies of Canada and Alaska (Neuroptera: Hemerobiidae). Part III. The genus Micromus Rambur. Giornale Italiano di Entomologia, 19: 31-76. |
| ○ |
Klimaszewski, J. & Kevan, D. K. McE., 1990a. Distribution data for some Nearctic species of the genus Hemerobius Linnaeus and Wesmaelius Krüger (Neuroptera: Hemerobiidae). Supplement 2. Neuroptera International, 5: 205-210. |
| ○ |
Klimaszewski, J. & Kevan, D. K. McE., 1990b. New distribution data for some American species of the genus Hemerobius Linneaus, with a redescription of Hemerobius alpestris Banks (Neuroptera: Hemerobiidae). Annals of the Transvaal Museum, 35: 151-155. |
| ○ |
Klimaszewski, J. & Kevan, D. K. McE., 1990c. The genus Micromus Rambur in North America, with special reference to Canada and Alaska, a synopsis (Insecta: Neuroptera: Hemerobiidae). In: M. W. Mansell & H. Aspöck (eds.). Advances in Neuropterology (Proceedings of the Third International Symposium on Neuropterology, February 1988, Berg en Dal). South African Department of Agricultural Development. Pretoria: 63-66. |
| ○ |
Klimaszewski, J. & Kevan, D. K. McE., 1992. Review of Canadian and Alaskan brown lacewing flies (Neuroptera: Hemerobiidae) with a key to the genera. Part IV: The genera Megalomus Rambur, Boriomyia Banks, Psectra Hagen and Sympherobius Banks. Annals of the Transvaal Museum, 35: 435-457. |
| ○ |
Klimaszewski, J., Kevan, D. K. McE. & Peck, S. B., 1987. A review of the Neuroptera of the Galápagos Islands with a new record for Sympherobius barberi (Banks) (Hemerobiidae). Canadian Journal of Zoology, 65: 3032-3040. http://dx.doi.org/10.1139/z87-459 |
| ○ |
Klimaszewski, J., Lesage, L. & Savard, K., 2009. First record of adventive species Micromus variegatus (Fabricius) from eastern Canada (Neuroptera, Hemerobiidae). ZooKeys, 27: 1-6. http://dx.doi.org/10.3897/zookeys.27.220 |
| ○ |
Klingstedt, H., 1931. Neuropterologisches aus Finnland 4. Die Verbreitung der Arten der Gattung Boriomyia. Memoranda Societatis pro Fauna et Flora Fennica, 7: 276-280. |
| ○ |
Knuth, P., 1909. Handbook of flower pollination: based upon Hermann Müller’s work ‘The fertilisation of flowers by insects’. Vol. 3. Clarendon Press. Oxford. 644 pp. |
| ○ |
Kozhanchikov, I. V., 1956. On the asiatic species of the genus Sympherobius Banks (Neuroptera, Hemerobiidae). Entomologicheskoe Obozrenie, 35: 696-705 |
| ○ |
Krakauer, A. H. & Tauber, C. A., 1996. Larvae of Micromus: generic characteristics and a description of Micromus subanticus (Neuroptera: Hemerobiidae). Annals of the Entomological Society of America, 89: 203-211. http://dx.doi.org/10.1093/aesa/89.2.203 |
| ○ |
Krüger, L., 1915. Neuroptera. Eine historisch-systematische übersicht. I. Neuroptera L. bis Neuroptera Erichs. Stettiner Entomologische Zeitung, 76: 3-51. |
| ○ |
Krüger, L., 1922. Hemerobiidae. Beiträge zu einer Monographie der Neuropteren-Familie der Hemerobiiden. Stettiner Entomologische Zeitung, 83: 138-172. |
| ○ |
Krüger, L., 1923. Neuroptera succinica baltica. Die im baltischen Bernstein eingeschlossenen Neuropteren des Westpreussischen Provinzial-Museums (heute Museum für Naturkunde und Vorgeschichte) in Danzig. Stettiner Entomologische Zeitung, 84: 68-92. |
| ○ |
Kuwayama, S., 1924. A contribution to the knowledge of the neuropterous insects of South Saghalien. Transactions of the Sapporo Natural History Society, 9: 93-140. |
| ○ |
Kuwayama, S., 1956. Further studies on the Neuroptera-Planipennia of the Kurile Islands. Insecta Matsumurana, 20: 77-82. |
| ○ |
Kuwayama, S., 1962. A revisional synopsis of the Neuroptera in Japan. Pacific Insects, 4: 325-412. |
| ○ |
Kuwayama, S., 1964. On the Neuroptera of the Ryukyus. Insecta Matsumurana, 27: 38-48. |
| ○ |
Lackschewitz, P., 1922. Die Neuropteren und Trichopteren des Ostbaltischen Gebietes. Eesti Loodusteaduse Arhiiv, (2), 14(3): 1-64. |
| ○ |
Lackschewitz, P., 1929. Nachtrag zu den Neuropteren und Trichopteren des Ostbaltischen Gebietes [Mecoptera Comst., Megaloptera Latr., Planipennia Latr., Trichoptera Kirby.]. Eesti Loodusteaduse Arhiiv, (2), 14(4): 1-40. |
| ○ |
Laffranque, J. P., 1973. Biologie du prédateur aphidiphage Boriomyia subnebulosa (Stephens) (Neuroptera: Hemerobiidae) et influence de l’alimentation sur son potentiel de multiplication. Thèse de Docteur-Ingénieur. Université Paul-Sabatier. Toulouse. 94 pp. |
| ○ |
Laffranque, J. P. & Canard, M., 1975. Biologie du prédateur aphidiphage Boriomyia subnebulosa (Stephens) (Neuroptera, Hemerobiidae): Études au laboratoire et dans les conditions hivernales du Sud-Ouest de la France. Annales de Zoologie, Écologie Animale, 7: 331-343. |
| ○ |
Laidlaw, W. B. R., 1936. The brown lacewing flies (Hemerobiidae): their importance as controls of Adelges cooleyi Gillette. The Entomologist’s Monthly Magazine, 72: 164-174. |
| ○ |
Lara, R. I. R. & Freitas S. de, 2002. Caracterização morfologica de adultos de Nusalala tessellata (Gerstaecker, 1888) (Neuroptera, Hemerobiidae). Revista Brasileira de Entomologia, 46: 521-528. |
| ○ |
Lara, R. I. R. & Freitas S. de, 2003. Caracterização morfológica de espécies de Hemerobius Linnaeus, 1758 (Neuroptera: Hemerobiidae) associadas a cultivos de café (Coffea arabica L.), milho (Zea mays L.) e ervamate (Ilex paraguariensis St.Hill.). Revista Brasileira de Entomología, 47, 3: 427-434. |
| ○ |
Lara, R. I. R. & Perioto, N. W., 2003. Bioecology of hemerobiids (Neuroptera, Hemerobiidae). Bioecologia de hemerobiideos (Neuroptera, Hemerobiidae). Arquivos do Instituto Biologico (São Paulo), 70: 517-523. |
| ○ |
Larsson, S. G., 1978. Baltic Amber - A Palaeobiological Study. Entomonograph Volume 1, Scandinavian Science Press. Klampenborg. 192 pp. |
| ○ |
Latreille, P. A., 1796. Précis des caractères génériques des insectes disposés dans un ordre naturel. Paris. 201 pp. |
| ○ |
Latreille, P. A., 1802. Histoire naturelle, générale et particulière de Crustacés et des Insectes. Vol. 3. Familles naturelles des genres. F. Dufart. Paris. 467 pp. |
| ○ |
Latreille, P. A., 1804. Histoire naturelle, genérale et particuliere, des Crustacés et des Insectes. Vol. 12. F. Dufart. Paris. 382 pp. |
| ○ |
Latreille, P. A., 1825. Familles naturelles du règne animal, exposées succinctement et dans un ordre analytique, avec l’indications de leurs genres. J.-B. Baillière. Paris. [vi]+570 pp. |
| ○ |
Latreille, P. A., 1831. Cours d’Entomologie ou de l’histoire naturelle des Crustacées, des Arachnides, des Myriapodes et des Insectes. Paris. |
| ○ |
Lems, K., 1952. Notities over Psectra diptera (Burmeister, 1839, Neur.). Entomologische Berichten, 14: 36-40. |
| ○ |
Leraut, P., 1982. Étude de quelques types de Névroptères décrits par J. Lacroix et par L. Navas conservés au Muséum National d’Histoire Naturelle a Paris [Neuroptera]. Revue Française d’Entomologie (N.S.), 4: 48. |
| ○ |
Leraut, P., 1989. Wesmaelius martinae n. sp, nouvelle espèce française d’Hemerobiidae [Neur.]. Bulletin de la Société Entomologique de France, 93: 285-287. |
| ○ |
Leraut, P., 1991a. Contribution à l’étude des hémérobes. 2. Sympherobius luqueti sp. n. une nouveauté remarquable du mont Ventoux (Neur. Hemerobiidae). Entomologica Gallica, 2: 125-126. |
| ○ |
Leraut, P., 1991b. Contribution à l’étude des hémérobes. 3. Hemerobius ballaudi sp. n. en France (Neur. Hemerobiidae). Entomologica Gallica, 2: 189-190. |
| ○ |
Lestage, J. A., 1925. Un Micromus nouveau du Congo Belge (Micromus Carpentieri sp. nov.) (Insecta: Planipennia). Revue Zoologique Africaine, 13: 57-59. |
| ○ |
Lestage, J. A., 1928. Recherches sur les Névroptères (sensu lato) coccidophages récoltés en Algérie par M. Balachowsky. Bulletin de la Société d’Histoire Naturelle de l’Afrique du Nord, 19: 150-155. |
| ○ |
Lestage, J. A., 1929. Notes sur l’entomofaune de l’Indochine. III. Les Micromus tonkinois (Planipennia). Bulletin et Annales de la Société Royale Entomologique de Belgique, 68: 265-268. |
| ○ |
Letardi, A., 1997. Myrmeleon bore (Tjeder, 1941) new to Spain (Neuroptera Myrmeleontidae). Frustula Entomologica (N.S.), 20: 150-151. |
| ○ |
Letardi, A., Almeida, J. M., Badano, D., Silva, R. R. & Machado, E., 2013. Contributing to a Checklist of Neuropterida in Portugal: The Naturdata Project. Açoreana, Suplemento 9: 29-38. |
| ○ |
Linnaeus, C., 1758. Systema natura per regna tria naturae secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Editio decima, reformata. Tomus I. Salvii. Holmiae. 824 pp. |
| ○ |
Linnaeus, C., 1761. Fauna Svecica, sistens animalia Sveciae regni: Mammalia, Aves, Amphibia, Pices, Insecta, Vermes distributa per classes & ordines, genera & species, cum differentiis specierum, synonymis auctorum, nominibus natalium, descriptionibus insectorum. Editio altera, auctior. Laurentii Salvii. Stockholmiae. 578 pp. |
| ○ |
Linnaeus, C., 1767. Systema natura per regna tria naturae secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Editio duodecima reformata. Tom. I. Pars II. Laurentii Salvii. Holmiae. pp. 533-1327. |
| ○ |
Lipkow, E., 1969. Cynipoidea und Ichneumonidae [Hym.] als Parasiten von Boriomyia subnebulosa (Steph.) [Neur., Hemerobiidae]. Entomophaga, 14: 229-241. |
| ○ |
Lucas, W. J., 1905. Neuroptera collected by Dr. T. A. Chapman in France and Spain 1904. The Entomologist, 38: 296-298. |
| ○ |
Lucas, W.J., 1906. Neuroptera and Trichoptera taken by Dr. T. A. Chapman in Spain, 1906. The Entomologist, 39: 276-277. |
| ○ |
Luquet, G. C., 1991. Breves remarques a propos de l’hibernation des imagos de Micromus angulatus Stephens (Neuroptera Hemerobiidae). Entomologica Gallica, 2: 170. |
| ○ |
Macho Bariego, V., 1909. Excursión anual de la Sociedad Aragonesa de Ciencias Naturales al Pirineo Aragonés (8-15 Julio de 1907). Boletín de la Sociedad Aragonesa de Ciencias Naturales, 8: 67-79. |
| ○ |
MacLeod, E. G., 1960a. The immature stages of Boriomyia fidelis (Banks) with taxonomic notes on the affinities of the genus Boriomyia (Neuroptera: Hemerobiidae). Psyche, 67: 26-40. |
| ○ |
MacLeod, E. G., 1960b. Sexual differences in the proportions of two-winged and four-winged individuals of Psectra diptera (Burmeister), together with five new records (Neuroptera: Hemerobiidae). Entomological News, 71: 231-236. |
| ○ |
MacLeod, E. G., 1963. A description of the male of Sympherobius arizonicus Banks (Neuroptera: Hemerobiidae). Psyche, 70: 64-67. |
| ○ |
MacLeod, E. G., 1964. Comment on the proposed validation of Boriomyia Banks, 1905. Z.N.(S.). 1531. Bulletin of Zoological Nomenclature, 21: 193-194. |
| ○ |
MacLeod, E. G., 1970. The Neuroptera of the Baltic Amber. I. Ascalaphidae, Nymphidae, and Psychopsidae. Psyche, 77: 147-180. http://dx.doi.org/10.1155/1970/45459 |
| ○ |
MacLeod, E. G. & Stange, L. A., 1981. The brown lacewings of Florida (Neuroptera: Hemerobiidae). Florida Department of Agriculture and Consumer Services, Division of Plant Industry, Entomology Circular, 227: 1-4. |
| ○ |
MacLeod, E. G. & Stange, L. A., 2001. Brown Lacewings (of Florida) (Insecta: Neuroptera: Hemerobiidae). UF University of Florida, IFAS Extension, 225: 1-6. |
| ○ |
Makarkin, V. N., 1984. Setčatokrylye semejstva Hemerobiidae (Neuroptera) Mongolii. Nasekomye Mongolii, 9: 418-422. |
| ○ |
Makarkin, V. N., 1985. Obzor setčatokrylyh sem. Hemerobiidae (Neuroptera) fauny SSSR. 1. Rody Hemerobius L., Micromus Ramb. i Paramicromus Nakah. Entomologicheskoe Obozrenie, 64: 158-170, 237. |
| ○ |
Makarkin, V. N., 1986. Obzor setčatokrylyh sem. Hemerobiidae (Neuroptera) fauny SSSR. 2. Rody Wesmaelius Krüger, Sympherobius Banks, Psectra Hagen, Megalomus Ramb., Neuronema McLach. i Drepanepteryx Leach. Entomologicheskoe Obozrenie, 65: 604-617. |
| ○ |
Makarkin, V. N., 1990. A check-list of the Neuroptera-Planipennia of the USSR far East, with some taxonomic remarks. Acta Zoologica Hungarica, 36: 37-45. |
| ○ |
Makarkin, V. N., 1991a. Miotsenovye setchatokrylye (Neuroptera) severnogo Kavkaza i Sikhote-Alinya. Paleontologicheskii Zhurnal, 1991(1): 57-68. |
| ○ |
Makarkin, V. N., 1991b. Vidovoj sostav i èkologičeskoe raspredelenie gemerobiid (Neuroptera: Hemerobiidae) Primor′â. Flora i fauna Primorskogo kraâ i sopredel′nyh territorij. – Ussurijsk: 240-243. |
| ○ |
Makarkin, V. N., 1993. The brown lacewings from Vietnam (Neuroptera Hemerobiidae). Tropical Zoology, 6: 217-226. http://dx.doi.org/10.1080/03946975.1993.10539222 |
| ○ |
Makarkin, V. N., 1994. The Oriental Hemerobiidae (Insecta: Neuroptera) described by Waro Nakahara. Raffles Bulletin of Zoology, 42: 917-926. |
| ○ |
Makarkin, V. N., 1995. Notes on Palearctic Hemerobiidae (Neuroptera). I. Introduction and genus Wesmaelius Kruger, 1922. Part 1. Subgenus Wesmaelius. Far Eastern Entomologist, 24: 1-13. |
| ○ |
Makarkin, V. N., 1996a. Notes on Palearctic Hemerobiidae (Neuroptera). I. Introduction and genus Wesmaelius Kruger, 1922. Part 2 (1). Subgenus Kimminsia Killington 1937. Far Eastern Entomologist, 31: 1-16. |
| ○ |
Makarkin, V. N., 1996b. Notes on Palearctic Hemerobiidae (Neuroptera). I. Introduction and genus Wesmaelius Kruger, 1922. Part 2(2). Subgenus Kimminsia Killington 1937. Far Eastern Entomologist, 32: 17-34. |
| ○ |
Makarkin, V. N., Archibald, S. B. & Oswald, J. D., 2003. New early Eocene brown lacewings (Neuroptera: Hemerobiidae) from western North America. The Canadian Entomologist, 135: 637-653. http://dx.doi.org/10.4039/n02-122 |
| ○ |
Makarkin, V. N. & Kholin, S. K., 1995. Sexual differences in relative length of forewing in Hemerobiidae (Neuroptera). Beiträge zur Entomologie, 45: 421-425 |
| ○ |
Makarkin, V. N. & Monserrat, V. J., 2007. Notes on the identity of Hemerobius amurensis Navás, 1929 (Neuroptera, Hemerobiidae). Deutsche Entomologische Zeitung, 54(2): 267-270. |
| ○ |
Makarkin, V. N. & Wedmann, S., 2009. First record of the genus Sympherobius (Neuroptera: Hemerobiidae) from Baltic amber. Zootaxa, 2078: 55-62. |
| ○ |
Makarkin, V. N., Wedmann, S. & Weiterschan, T., 2012. First record of a fossil larva of Hemerobiidae (Neuroptera) from Baltic amber. Zootaxa, 3417: 53-63. |
| ○ |
Mansell, M. W., 1986. 19. Order Neuroptera. In: C. H. Scholtz & E. Holm (eds.). Insects of Southern Africa. Butterworths. Durban: 181-187. |
| ○ |
Manuel, R. L., 1981. An unusual case of parasitism in a larva of Hemerobius humulinus L. (Neuroptera: Hemerobiidae). Annals of the Entomological Society of Quebec, 26: 215-216. |
| ○ |
Marín, F., 1994. Las comunidades de neuropteros de la provincia de Albacete (Insecta: Neuropteroidea). Al-Basit, Estudios albacetenses, 34: 247-304. |
| ○ |
Marín, F. & Monserrat, V. J., 1987. Los neurópteros del encinar ibérico (Insecta, Neuropteroidea). Boletín de Sanidad Vegetal, Plagas, 13: 347-359. |
| ○ |
Marín, F. & Monserrat, V. J., 1989. Contribución al conocimiento de los neurópteros de Cantabria (Insecta, Neuropteroidea). Boletín de la Asociacion Española de Entomología, 13: 287-298. |
| ○ |
Marín, F. & Monserrat, V. J., 1990. Contribución al conocimiento de los neurópteros de Soria. (Insecta, Neuropteroidea). Boletín de la Asociacion Española de Entomología, 14: 219-230. |
| ○ |
Marín, F. & Monserrat, V. J., 1991a. Contribución al conocimiento de los neurópteros de Albacete (Insecta, Planipennia). Jornadas sobre el Medio Natural Albacetense, Albacete, 1990: 179-184. |
| ○ |
Marín, F. & Monserrat, V. J., 1991b. The Community of Neuropteroidea from Iberian southern beechwoods. In: L. Polgar, R. J. Chambers, A. F. G. Dixon & I. Hodek (eds.). Behaviour and impact of Aphidophaga (Proceedings of the 4th meeting of the IOBC). SPB Academic Publishing. The Hague: 187-198. |
| ○ |
Marín, F. & Monserrat, V. J., 1995a. Contribución al conocimiento de los neurópteros de Zaragoza (Insecta, Neuropteroidea). Zapateri, 5: 109-126. |
| ○ |
Marín, F. & Monserrat, V. J., 1995b. Contribución al conocimiento de los neurópteros de Valencia (Insecta, Neuroptera). Boletín de la Asociacion Española de Entomología, 19 (3-4): 35-49. |
| ○ |
Martynova, O. M., 1952. Permskie setchatokrylye SSSR. In: Y. A. Orlov (ed.). Materialy po faune paleozoya. Trudy Paleontologicheskogo Instituta, 40: 197-237. |
| ○ |
Martynova, O. M., 1961. Nadotryad Neuropteroidea. In: B. B. Rohdendorf, E. E. Becker-Migdisova, O. M. Martynova & A. G. Sharov. Paleozoiskie nasekomye kuznetskogo basseina. Trudy Paleontologicheskogo Instituta, 85: 469-487, 606, 656-657. |
| ○ |
McClendon, J. F., 1906. Notes on the true Neuroptera. 2. On venation in Neuroptera. Entomological News, 17: 116-121. |
| ○ |
McEwen, P., New, T. R. & Whittington, A. E. (eds.), 2001. Lacewings in the Crop Environment, Cambridge University Press. Cambridge. 546 pp. |
| ○ |
McEwen, P. K. & Oswald, J. [D.] 1998. Neuroptera on the Internet. In: S. P. Panelius (ed.). Neuropterology 1997 (Proceedings of the Sixth International Symposium on Neuropterology, July 1997, Helsinki). Acta Zoologica Fennica, 209: 151-152. |
| ○ |
McLachlan, R., 1863. On some new species of neuropterous insects from Australia and New Zealand, belonging to the family Hemerobiidae. Journal of Entomology: descriptive and geographical, 2: 111-116. |
| ○ |
McLachlan, R., 1867. New genera and species, &c., of neuropterous insects; and a revision of Mr. F. Walker’s British Museum Catalogue of Neuroptera, part ii. (1853), as far as the end of the genus Myrmeleon. Journal of the Linnean Society of London, Zoology, 9: 230-281. |
| ○ |
McLachlan, R., 1868. A monograph of the British Neuroptera-Planipennia. Transactions of the Royal Entomological Society of London, 16: 145-224. http://dx.doi.org/10.1111/j.1365-2311.1868.tb00622.x |
| ○ |
McLachlan, R., 1869. New species, &c., of Hemerobiina; with synonymic notes (first series). The Entomologist’s Monthly Magazine, 6: 21-27. |
| ○ |
McLachlan, R., 1880. Notes on the entomology of Portugal. II. Pseudo-Neuroptera (in part) & Neuroptera-Planipennia. The Entomologist’s Monthly Magazine, 17: 103-108. |
| ○ |
McLachlan, R., 1899. Notes on certain Palaeartic species of the genus Hemerobius. The Entomologist’s Monthly Magazine, 35: 77-80, 127-133. |
| ○ |
McLachlan, R., 1902a. An annotated list of Neuroptera-Planipennia collected in central Spain by Dr. T. A. Chapman and Mr. G. C. Champion in July and August, 1901. The Entomologist’s Monthly Magazine, 38: 129-131. |
| ○ |
McLachlan, R., 1902b. Trichoptera, Planipennia, and Odonata collected by Lord Walsingham in the vicinity of Granada (Spain) in 1901. The Entomologist’s Monthly Magazine, 38: 33-34. |
| ○ |
McLachlan, R., 1903. An annotated list of the Neuroptera Planipennia collected in West Central Spain by Dr. T. A. Chapman and Mr. G. C. Champion in June and July, 1902. The Entomologist’s Monthly Magazine, 39: 224-225. |
| ○ |
Meinander, M., 1965. Some Neuroptera from the Canary Islands and the Spanish Sahara. Notulae Entomologicae, 45: 53-60. |
| ○ |
Mendel, Z., Adar, K., Nestel, D. & Dunkelblum, E., 1997. Sex pheromone traps as a tool for the study of population trends of the predator of a scale insect and for the identification of potential predators for biological control. International Organisation for Biological and Integrated Control of Noxious Animals and Plants, Bulletin, 20: 231-240. |
| ○ |
Mendel, Z., Assael, F. & Dunkelblum, E., 2004. Kairomonal attraction of predatory bugs (Heteroptera: Anthocoridae) and brown lacewings (Neuroptera: Hemerobiidae) to sex pheromones of Matsucoccus species (Hemiptera: Matsucoccidae). Biological Control, 30: 134-140. http://dx.doi.org/10.1016/j.biocontrol.2003.06.001 |
| ○ |
Miermont, Y., 1973. Étude au laboratoire de l’alimentation d’un prédateur aphidiphage: Eumicromus angulatus Steph. (Neuroptera: Hemerobiidae). Thèse de Docteur-Ingénieur, Université Paul-Sabatier. Toulouse. 103 pp. |
| ○ |
Miermont, Y. & Canard, M., 1975. Biologie du prédateur aphidiphage Eumicromus angulatus (Neur., Hemerobiidae): études au laboratoire et observations dans le sud-ouest de la France. Entomophaga, 20: 179-191. |
| ○ |
Miles, H. W., 1924. On the life history of Boriomyia (Hemerobius) nervosa, Fab. (Planipennia, Hemerobiidae). Bulletin of Entomological Research, 14: 249-250. |
| ○ |
Miller, G. L. & Cave, R. D., 1987. Bionomics of Micromus posticus (Walker) (Neuroptera: Hemerobiidae) with descriptions of the immature stages. Proceedings of the Entomological Society of Washington, 89: 776-789. |
| ○ |
Miller, G. L. & Lambdin, P. L., 1982. Hemerobius stigma Stephens (Neuroptera: Hemerobiidae): external morphology of the egg. Proceedings of the Entomological Society of Washington, 84: 204-207. |
| ○ |
Miller, G. L. & Lambdin, P. L., 1984. Redescriptions of the larval stages of Hemerobius stigma Stephens (Neuroptera: Hemerobiidae). The Florida Entomologist, 67: 377-382. http://dx.doi.org/10.2307/3494716 |
| ○ |
Miller, G. L. & Lambdin, P. L., 1985. Observations on Anacharis melanoneura (Hymenoptera: Figitidae), a parasite of Hemerobius stigma (Neuroptera: Hemerobiidae). Entomological News, 96: 93-97. |
| ○ |
Miller, G. L., Oswald, J. D. & Miller, D. R., 2004. Lacewings and scale insects: a review of predator/prey associations between the Neuropterida and Coccoidea (Insecta: Neuroptera, Raphidioptera, Hemiptera). Annals of the Entomological Society of America, 97: 1103-1125. http://dx.doi.org/10.1603/0013-8746(2004)097%5B1103:LASIAR%5D2.0.CO;2 |
| ○ |
Mjöberg, E. [G.] 1909. Über eine neue, schwedische Hemerobius-Art. Entomologisk Tidskrift, 30: 177-179. |
| ○ |
Mjöberg, E. [G.] 1910. Über Psectra diptera Burm. Arkiv för Zoologi, 6(5): 1-15. |
| ○ |
Monserrat, V. J., 1976a. Una nueva especie del género Sympherobius en España (Neuroptera s.str., Hemerobiidae). Nouvelle Revue d’Entomologie, 6(2): 199-203. |
| ○ |
Monserrat, V. J., 1976b. Un nuevo Hemeróbido de España (Neuroptera, Planipennia, Hemerobiidae). Bulletin de la Société d’histoire naturelle de Toulouse, 112(1-2): 16-22. |
| ○ |
Monserrat, V. J., 1977. Neuroptera (Planipennia) de la Sierra del Guadarrama. Trabajos de la Cátedra de Artrópodos. Facultad de Biología, Universidad Complutense, 19: 1-202. |
| ○ |
Monserrat, V. J., 1978a. Contribución al conocimiento de los Neurópteros de Orense (Neu. Planipennia). Boletín de la asociación Española de Entomología, 2: 169-184. |
| ○ |
Monserrat, V. J., 1978b. Kimminsia rava (Withycombe 1923) nueva para la fauna española (Insecta, Planipennia, Hemerobiidae). Miscelánea Zoológica, 4(2): 177-181. |
| ○ |
Monserrat, V. J., 1978c. Primera contribución al conocimiento de los Neurópteros de Cádiz (Insecta, Neuroptera, Planipennia). Boletín de la Real Sociedad Española de Historia Natural, Sección Biológica, 76: 57-70. |
| ○ |
Monserrat, V. J., 1979a. Segunda contribución al conocimiento de los neurópteros de Cádiz (Insecta, Planipennia). Boletín de la Real Sociedad Española de Historia Natural, Sección Biológica, 77: 409-417. |
| ○ |
Monserrat, V. J., 1979b. Sobre los Neurópteros Ibéricos (II); (Neuroptera, Planipennia). Boletín de la Asociacion Española de Entomología, 3: 17-21. |
| ○ |
Monserrat, V. J., 1980a. Sobre los Neurópteros Ibéricos (I). (Neuroptera, Planipennia). Graellsia, [1978], 34: 171-176. |
| ○ |
Monserrat, V. J., 1980b. Contribución al conocimiento de los Neurópteros de Toledo. Graellsia, [1978], 34: 177-193. |
| ○ |
Monserrat, V. J., 1980c. Sobre las especies africanas del género Notiobiella Banks, 1909 (Neuroptera, Planipennia, Hemerobiidae) I. Neuroptera International, 1(1): 26-33. |
| ○ |
Monserrat, V. J., 1981. Sobre los Neurópteros Ibéricos (III), (Neuroptera, Planipennia). Boletín de la Asociacion Española de Entomología, [1980], 4: 151-156. |
| ○ |
Monserrat, V. J., 1982. Contribución al conocimiento de los neurópteros de Cáceres (Neur., Planipennia). Graellsia, 38: 67-84. |
| ○ |
Monserrat, V. J., 1983a. Sobre los Neurópteros de las Islas Canarias, IV: Wesmaelius (Kimminsia) navasi (Andréu, 1911). (Neur., Plan. Hemerobiidae). Boletín de la asociación Española de Entomología, 6(2): 209-224. |
| ○ |
Monserrat, V. J., 1983b. Pterocroce capillaris (Klug, 1836) en Europa (Neur., Plan., Nemopteridae). Neuroptera International, 2: 109-128. |
| ○ |
Monserrat, V. J., 1984a. Contribución al conocimiento de los neurópteros de Huesca (Neuroptera, Planipennia). Pirineos, 121: 29-50. |
| ○ |
Monserrat, V. J., 1984b. Contribución al conocimiento de los neurópteros de Salamanca (Neur., Planipennia). Eos, 59 (1983): 165-177. |
| ○ |
Monserrat, V. J., 1984c. Sobre las Especies Africanas del Género Notiobiella Banks, 1909, II. (Neuroptera, Planipennia, Hemerobiidae). In: J. Gepp, H. Aspöck & H. Hölzel (eds.). Progress in World’s Neuropterology (Proceedings of the 1st International Symposium on Neuropterology, September 1980, Graz). Graz: 99-124. |
| ○ |
Monserrat, V. J., 1984d. Contribución al conocimiento de los neurópteros de Alicante (Neur., Planipennia). Mediterranea, Serie Biología, 7: 91-116. |
| ○ |
Monserrat, V. J., 1984e. Contribución al conocimiento de los neurópteros de Zamora (Neur. Planipennia). Miscel·lània Zoològica, 8: 153-163. |
| ○ |
Monserrat, V. J., 1984f. Sobre las especies Americanas del género Notiobiella Banks, 1909, I. (Neuroptera, Planipennia, Hemerobiidae). In: J. Gepp, H. Aspöck & H. Hölzel (eds.). Progress in World’s Neuropterology (Proceedings of the 1st International Symposium on Neuropterology, September 1980, Graz). Graz: 85-97. |
| ○ |
Monserrat, V. J., 1985a. Lista de los tipos de Mecoptera y Neuroptera (Insecta) de la colección L. Navàs, depositados en el Museo de Zoología de Barcelona. Miscel·lània Zoològica, 9: 233-243. |
| ○ |
Monserrat, V. J., 1985b. Contribución al conocimiento de los Neurópteros (Neuroptera: Planipennia) de Murcia. Anales de Biología (Biología Animal), 1: 81-94. |
| ○ |
Monserrat, V. J., 1985c. Contribución al conocimiento de los neurópteros de Lugo (Neur., Planipennia). Trabajos Compostelanos de Biología, 12: 87-98. |
| ○ |
Monserrat, V. J., 1986a. Sinopsis de los hemeróbidos de la Península Ibérica (Neuroptera, Planipennia, Hemerobiidae). Actas de las VIII Jornadas de la Asociación española de Entomología, Sevilla: 1200-1223. |
| ○ |
Monserrat, V. J., 1986b. Sobre los Neurópteros ibéricos (IV) (Neur.). Boletín de la Asociacion Española de Entomología, 10: 95-105. |
| ○ |
Monserrat, V. J., 1986c. Longinos Navás, his neuropterological work and collection. In: J. Gepp, H. Aspöck & H. Hölzel (eds.). Recent Research in Neuropterology (Proceedings of the 2nd International Symposium on Neuropterology, August 1984, Hamburg). Graz: 173-176. |
| ○ |
Monserrat, V. J., 1987. Contribución al conocimiento de los Neurópteros de Almería (Neur., Planipennia). Graellsia, [1986], 42: 131-147. |
| ○ |
Monserrat, V. J., 1989. Algunos Neurópteros del Museo de Basilea (Insecta, Neuropteroidea, Planipennia). Entomologica Basiliensia, 13: 417-428. |
| ○ |
Monserrat, V. J., 1990a. Some brown lacewings from Equatorial Guinea (Neuroptera, Planipennia: Hemerobiidae). Journal of African Zoology, 104: 17-22. |
| ○ |
Monserrat, V. J., 1990b. Systematic studies on Hemerobiidae (Insecta: Neuroptera). In: M. W. Mansell & H. Aspöck (eds.). Advances in Neuropterology (Proceedings of the Third International Symposium on Neuropterology, February 1988, Berg en Dal). South African Department of Agricultural Development. Pretoria: 67-88. |
| ○ |
Monserrat, V. J., 1990c. A systematic checklist of the Hemerobiidae of the world (Insecta: Neuroptera). In: M. W. Mansell & H. Aspöck (eds.). Advances in Neuropterology (Proceedings of the Third International Symposium on Neuropterology, February 1988, Berg en Dal). South African Department of Agricultural Development. Pretoria: 215-262. |
| ○ |
Monserrat, V. J., 1990d. Revisión de la obra de L. Navas, II: El Género Micromus Rambur, 1842 (Neuropteroidea, Planipennia: Hemerobiidae). Graellsia, 46: 175-190. |
| ○ |
Monserrat, V. J., 1991a. Nuevos datos sobre algunas especies del género Hemerobius L., 1758 (Insecta, Neuroptera: Hemerobiidae). Graellsia, 47: 61-70. |
| ○ |
Monserrat, V. J., 1991b. Nuevos datos sobre los hemeróbidos ibéricos (Insecta, Neuroptera: Hemerobiidae). Zoologica Baetica, 2: 101-113. |
| ○ |
Monserrat, V. J., 1992a. New data on the Afrotropical brown lacewings (Neuroptera: Hemerobiidae). Journal of the entomological Society of Southern Africa, 55, 1: 123-136. |
| ○ |
Monserrat, V. J., 1992b. On some African species of the genus Micromus Rambur, 1842 (Insecta: Neuroptera: Hemerobiidae). In: M. Canard, H. Aspöck & M. W. Mansell (eds.). Current Research in Neuropterology (Proceedings of the Fourth International Symposium on Neuropterology, June 1991, Bagnères-de-Luchon). Toulouse: 271-278. |
| ○ |
Monserrat, V. J., 1993. New data on some species of the genus Micromus Rambur, 1842 (Insecta: Neuroptera: Hemerobiidae). Annali del Museo Civico di Storia Naturale “Giacomo Doria”, 89: 477-516. |
| ○ |
Monserrat, V. J., 1994. Nuevos datos sobre las especies de hemeróbidos ibéricos (Neuroptera: Hemerobiidae). Boletín de la Asociación española de Entomología, 18(3-4): 9-25. |
| ○ |
Monserrat, V. J., 1996a. Revision del genero Hemerobius de Latinoamérica (Neuroptera, Hemerobiidae). Fragmenta Entomologica, 27(2): 399-523. |
| ○ |
Monserrat, V. J., 1996b. Lista de los neurópteros de Aragón (Megaloptera, Raphidioptera, Planipennia). Catalogus de la entomofauna Aragonesa, 11: 11-17. |
| ○ |
Monserrat, V. J., 1997. Revisión del género Megalomus de Latinoamérica (Neuroptera, Hemerobiidae). Fragmenta Entomologica, 29: 123-206. |
| ○ |
Monserrat, V. J., 1998. Nuevos datos sobre los hemeróbidos de América (Neuroptera, Hemerobiidae). Journal of Neuropterology, 1: 109-153. |
| ○ |
Monserrat, V. J., 2000. Revisión del Género Nusalala (Neuroptera, Hemerobiidae). Fragmenta Entomologica, 32(1): 83-162. |
| ○ |
Monserrat, V. J., 2001. New data on the Brown Lacewings from Asia (Neuroptera, Hemerobiidae). Journal of Neuropterology, [2000], 3: 61-97. |
| ○ |
Monserrat, V. J., 2002. Family Hemerobiidae. In: N. D. Penny (ed.). A Guide to the Lacewings (Neuroptera) of Costa Rica. Proceedings of the California Academy of Sciences 53(12): 238-251, 398-418. |
| ○ |
Monserrat, V. J., 2003. Contribución al conocimiento de los hemeróbidos de Patagonia y Tierra del Fuego (Insecta, Neuroptera: Hemerobiidae). Graellsia, 59(1): 37-56. http://dx.doi.org/10.3989/graellsia.2003.v59.i1.222 |
| ○ |
Monserrat, V. J., 2004. Nuevos datos sobre algunas especies de hemeróbidos (Insecta: Neuroptera: Hemerobiidae). Heteropterus Revista de Entomología, 4: 1-26. |
| ○ |
Monserrat, V. J., 2005. Catálogo de los Neurópteros de Baleares con nuevos datos sobre su fauna (Insecta, Neuroptera). Bolletí de la Societat d′Història Natural de les Balears, 48: 71-85. |
| ○ |
Monserrat, V. J., 2008a. Nuevos datos sobre algunas especies de hemeróbidos (Insecta, Neuroptera, Hemerobiidae). Graellsia, 64(2): 233-253. http://dx.doi.org/10.3989/graellsia.2008.v64.i2.34 |
| ○ |
Monserrat, V. J., 2008b. Sobre la morfología y la ultraestructura del huevo en algunas especies de Hemerobiidae (Insecta, Neuroptera). Graellsia, 64(2): 265-273. http://dx.doi.org/10.3989/graellsia.2008.v64.i2.36 |
| ○ |
Monserrat, V. J., 2010. Nuevas o interesantes citas de neurópteros en la Península Ibérica (Insecta: Neuroptera). Heteropterus Revista de Entomología, 10(1): 19-34. |
| ○ |
Monserrat, V. J., 2011. Sobre algunas especies de neurópteros de la Península Ibérica y de las Islas Canarias de posición taxonómica problemática o con citas dudosas o cuestionables (Insecta, Neuroptera: Megaloptera, Planipennia). Boletín de la Sociedad Entomológica Aragonesa, 49: 153-178. |
| ○ |
Monserrat, V.J., 2013. Los Neurópteros (Neuroptera). In: F. Ruano, M. Tierno de Figueroa y A. Tinaut (eds). Los Insectos de Sierra Nevada. 200 años de historia, Vol. 1. Asociación española de Entomología. Granada: 281-309. |
| ○ |
Monserrat, V. J. & Deretsky, Z., 1999. New Faunistical, Taxonomic and Systematic Data on Brown Lacewings (Neuroptera: Hemerobiidae). Journal of Neuropterology, 2: 45-66. |
| ○ |
Monserrat, V. J. & Díaz-Aranda, L. M., 1987. Contribución al conocimiento de los neurópteros (Neur.: Raphidioptera, Planipennia) de Cuenca. Boletín de la Asociacion Española de Entomología, 11: 171-189. |
| ○ |
Monserrat, V. J. & Díaz-Aranda, L. M., 1988. Contribución al conocimiento de los Neurópteros de Castellón (Insecta, Neuropteroidea, Planipennia). Mediterranea, Serie Biología, 10: 87-95. |
| ○ |
Monserrat, V. J. & Díaz-Aranda, L. M., 1989. Contribución al conocimiento de los Neurópteros de Castellón (Insecta, Neuropteroidea, Planipennia). Mediterranea, Serie Biología, 11: 47-58. |
| ○ |
Monserrat, V. J., Gamarra, P. & Deretsky, Z., 1999. The Neuropterological Fauna of the Houses of the City of Madrid. Journal of Neuropterology, 2: 35-44. |
| ○ |
Monserrat, V. J. & Hölzel, H., 1987. Contribución al conocimiento de los neurópteros de Anatolia (Neuropteroidea, Planipennia). Eos, 63: 133-142. |
| ○ |
Monserrat, V. J. & Marín, F., 1996a. Plant substrate specificity of Iberian Hemerobiidae (Insecta: Neuroptera). Journal of Natural History, 30: 775-787. http://dx.doi.org/10.1080/00222939600770401 |
| ○ |
Monserrat, V. J. & Marín, F., 1996b. Plant substrate specificity of Iberian Hemerobiidae (Insecta: Neuroptera). In: M. Canard, H. Aspöck & M. W. Mansell (eds.). Pure and Applied Research in Neuropterology (Proceedings of the Fifth International Symposium on Neuropterology, May 1994, Cairo). Toulouse: 195. |
| ○ |
Monserrat, V. J. & Marín, F., 2001. Comparative plant substrate specificity of Iberian Hemerobiidae, Coniopterygidae and Chrysopidae. In: P. K. McEwen, T. R. New & A. E. Whittington (eds.). Lacewings in the crop environment. Cambridge University Press. Cambridge: 424-434. |
| ○ |
Monserrat, V. J., Marín, F. & Díaz-Aranda, L.M., 1994. Contribución al conocimiento de los neurópteros de Lérida (Insecta, Neuroptera). Zoologia Baetica, 5: 41-64. |
| ○ |
Monserrat, V. J., Oswald, J. D., Tauber, C. A. & Díaz-Aranda, L. M., 2001. Recognition of larval Neuroptera. Pp. 43-81. In: P. K. McEwen, T. R. New & A. E. Whittington (eds.). Lacewings in the crop environment. Cambridge University Press. Cambridge: 43-81. |
| ○ |
Monserrat, V. J. & Penny, N. D., 1983. Sobre las especies Americanas del genero Notiobiella Banks, 1909, II (Neuroptera, Planipennia, Hemerobiidae). Nouvelle Revue d’Entomologie, 13: 125-132. |
| ○ |
Monserrat, V. J. & Triviño, V., 2013. Atlas de los neurópteros de la Península Ibérica e Islas Baleares (Insecta, Neuroptera: Megaloptera, Raphidioptera, Planipennia)/Atlas of the Iberian and Balearic lacewings (Insecta, Neuroptera: Megaloptera, Raphidioptera, Planipennia). Monografías de la Sociedad Entomológica Aragonesa, vol. 13. Zaragoza. 154 pp., 136 mapas. |
| ○ |
Monserrat, V. J., Triviño, V. & Acevedo, F., 2013a. Contribución al conocimiento de los neurópteros de Navarra (Insecta, Neuroptera). Heteropterus Revista de Entomología, 13(1): 41-58. |
| ○ |
Monserrat, V. J., Triviño, V., Acevedo, F. & Garcia, A., 2013b. Nuevos datos sobre algunas especies de hemeróbidos de la Península Ibérica e Islas Canarias, incluyendo una nueva especie invasora de origen neotropical en Portugal (Insecta, Neuroptera: Hemerobiidae). Graellsia, 69(2): 157-168. http://dx.doi.org/10.3989/graellsia.2013.v69.083 |
| ○ |
Morgan, M. J., 1980. Contribución al catálogo faunístico del Coto Nacional de las Sierras de Cazorla y Segura. Neuroptera: In: M. G. de Viedma (ed.). Fauna de Cazorla. Invertebrados. Monografías ICONA, 23. Ministerio Agricultura. Madrid: 119 pp. |
| ○ |
Morinière, J., Hendrich, L., Hausmann, A., Hebert, P., Haszprunar, G. & Gruppe, A., 2014. Barcoding Fauna Bavarica: 78% of the Neuropterida Fauna Barcoded! PLoS ONE 9(10): e109719. http://dx.doi.org/10.1371/journal.pone.0109719 |
| ○ |
Morton, K. J., 1910. Life-history of Drepanepteryx phalaenoides, Linn. The Entomologist’s Monthly Magazine, 46: 54-62. |
| ○ |
Morton, K. J., 1912. A collecting trip to the Camargue and the Sierra Albarracin. The Entomologist, 45: 109-114. |
| ○ |
Morton, K. J., 1931. Hemerobius perelegans Stephens: a good species. The Entomologist, 64: 197-201. |
| ○ |
Morton, K. J., 1935. Remarks on the name of Boriomyia nervosa Fabr. The Entomologist’s Monthly Magazine, 71: 95-100. |
| ○ |
Mosely, M.E., 1932a. Trichoptera, Neuroptera, etc., collected in the Pyrenees. The Entomologist, 65: 276-282. |
| ○ |
Mosely, M. E., 1932b. Corsican Trichoptera and Neuroptera (s.l.) 1931. Eos, 8: 165-184. |
| ○ |
Moznette, G. F., 1915a. Notes on the brown lace-wing (Hemerobius pacificus, Bks.). Journal of Economic Entomology, 8: 350-354. http://dx.doi.org/10.1093/jee/8.3.350 |
| ○ |
Moznette, G. F., 1915b. The brown lacewing Hemerobius pacificus Banks. Second Biennial Crop Pest and Horticultural Report, Corvallis 1913-1914: 181-183. |
| ○ |
Nagler, C., 1958. Citeva date privitoare la raspindirea unor Neuroptere (Ord. Planipennia Heymos 1915) in R.P.R. Studii si cercetari stiintifice. Biologie si stiinte agricole. Academia Republicii Populare Romîne, Filiala Iasi, 9(2): 229-303. |
| ○ |
Nakahara, W., 1915a. On the Hemerobiinae of Japan. Annotationes Zoologicae Japonenses, 9: 11-48. |
| ○ |
Nakahara, W., 1915b. Catalogus Hemerobidarum Japonicum. Entomological Magazine, 1: 97-102. |
| ○ |
Nakahara, W., 1915c. On the family Hemerobiidae. Konchu Sekai, 19: 271-273. |
| ○ |
Nakahara, W., 1919. Revisional notes on the Japanese Hemerobiidae. Konchu Sekai, 23: 135-137. |
| ○ |
Nakahara, W., 1954. Early stages of some Japanese Hemerobiidae including two new species. Kontyû, 21: 41-46. |
| ○ |
Nakahara, W., 1955. Formosan Neuroptera collected by the late Dr. T. Kano. Kontyû, 23:6-12. |
| ○ |
Nakahara, W., 1956. New or little known Hemerobiidae from Japan and adjacent territories (Neuroptera). Kontyû, 24: 182-191. |
| ○ |
Nakahara, W., 1960a. Systematic studies on the Hemerobiidae (Neuroptera). Mushi, 34: 1-69. |
| ○ |
Nakahara, W., 1960b. Hemerobiidae, Sisyridae, Berothidae and Osmylidae of Niigata Prefecture, Japan, collected by Dr.Kintaro Baba (en japonés). Niigata Prefecture insect, 4: 33-34. |
| ○ |
Nakahara, W., 1960c. The Hemerobiidae from New Caledonia. Bulletin of the Osaka Museum of Natural History, 12: 39-41. |
| ○ |
Nakahara, W., 1964. Neuroptera of Ryukyu collected chiefly under the auspice of the Japan-U.S. co-operative science program. Kontyû, 32: 245-248. |
| ○ |
Nakahara, W., 1966a. Hemerobiidae, Sisyridae and Osmylidae of Formosa and Ryukyu Islands (Neuroptera). Kontyû, 34(3): 193-207. |
| ○ |
Nakahara, W., 1966b. Neotropical Hemerobiidae in the United States National Museum. Proceedings of the United States National Museum, 117: 107-122. http://dx.doi.org/10.5479/si.00963801.117-3509.107 |
| ○ |
Nakahara, W., 1966c. Contributions to the knowledge of the Hemerobiidae of western North America (Neuroptera). Proceedings of the United States National Museum, 116: 205-222. http://dx.doi.org/10.5479/si.00963801.116-3503.205 |
| ○ |
Nakahara, W., 1971. Some genera and species of the Hemerobiidae (Neuroptera). Kontyû, 39: 7-14. |
| ○ |
Nakahara, W. & Kuwayama, S., 1961. Neuroptera-Planipennia from Thailand. Nature and Life in Southeast Asia, 1: 259-263. |
| ○ |
Navás, L., 1904a. Notas zoológicas. II. Neurópteros de la provincia de Barcelona cogidos por el P.Eugenio Saz S.J. Boletín de la Sociedad aragonesa de Ciencias Naturales, 3: 10-16 (122-127). |
| ○ |
Navás, L., 1904b. Excursión al Moncayo. Boletín de la Sociedad aragonesa de Ciencias Naturales, 3: 139-167. |
| ○ |
Navás, L., 1905a. Notas entomológicas. XII. Neurópteros de Pozuelo de Calatrava (C.Real). Boletín de la Real Sociedad Española de Historia Natural, 5: 503-509. |
| ○ |
Navás, L., 1905b. Notas neuropterológicas. VI. Neurópteros de Montserrat. Butlletí de la Institució Catalana d’Història Natural, 5: 11-21. |
| ○ |
Navás, L., 1905c. Catálogo descriptivo de los insectos Neurópteros de los alrededores de Madrid. Revista de la Real Academia de Ciencias Exactas, Físicas y Naturales de Madrid, 2,4: 1-54. |
| ○ |
Navás, L., 1906. Catálogo descriptivo de los insectos Neurópteros de las Islas Canarias. Revista de la Real Academia de Ciencias Exactas, Físicas y Naturales de Madrid, 4: 687-706. |
| ○ |
Navás, L., 1908. Neurópteros de España y Portugal. Brotéria (Serie Zoologica), 7: 5-131. |
| ○ |
Navás, L., 1909a. Notas entomológicas V. Neurópteros del Monzayo y Zaragoza. Actas de la Sociedad Española de Historia Natural, 29: 172-176. |
| ○ |
Navás, L., 1909b. Neurópteros de los alrededores de Madrid. Revista de la Real Academia de Ciencias Exactas, Físicas y Naturales de Madrid, 8: 370-380. |
| ○ |
Navás, L., 1909c. Deux Hémérobides (insectes névroptères) nouveaux. Annales de la Société Scientifique de Bruxelles, 33(1): 215-220. |
| ○ |
Navás, L., 1910. Notas entomológicas (2.Serie).2. Excursiones por Cataluña y Mallorca. Boletín de la Sociedad aragonesa de Ciencias Naturales, 9: 240-248. |
| ○ |
Navás, L., 1911. Excursiones por los alrededores de Granada. Boletín de la Sociedad aragonesa de Ciencias Naturales, 10: 204-211. |
| ○ |
Navás, L., 1912. Insectes Névroptères de Crimée. Zoologicheskii Muzei, Ezhegodnik, 16: 528-534. |
| ○ |
Navás, L., 1913a. Cuatro pequeñas colecciones de Neurópteros de la Península Ibérica. Boletín de la Sociedad aragonesa de Ciencias Naturales, 12: 77-91. |
| ○ |
Navás, L., 1913b. Excursiones por los alrededores de Zaragoza. Boletín de la Sociedad aragonesa de Ciencias Naturales, 12: 61-69, 75-77. |
| ○ |
Navás, L., 1913c. Notas entomológicas, 2.a serie. 6. Visita a San Esteban de Litera (Huesca). Boletín de la Sociedad Aragonesa de Ciencias Naturales, 12: 89-91, 98-101. |
| ○ |
Navás, L., 1914a. Algunos neurópteros de los alrededores de Madrid. Boletín de la Sociedad aragonesa de Ciencias Naturales, 13: 38-41. |
| ○ |
Navás, L., 1914b. Excursión anual de la Sociedad Aragonesa de Ciencias Naturales a Ortigosa y Valvanera (Logroño). Conclusión. Boletín de la Sociedad aragonesa de Ciencias Naturales, 13: 29-37. |
| ○ |
Navás, L., 1914c. Neuropteros del Moncayo (Zaragoza). Boletín de la Sociedad aragonesa de Ciencias Naturales, 13: 207-218. |
| ○ |
Navás, L., 1914d. Neuropteros de Mallorca. Boletín de la Sociedad aragonesa de Ciencias Naturales, 13(9): 185-192. |
| ○ |
Navás, L., 1915a. Notas entomológicas, 2a Serie. Excursiones por Cataluña. Julio 1914. Boletín de la Sociedad aragonesa de Ciencias Naturales, 14: 27-32, 35-59, 66-80. |
| ○ |
Navás, L., 1915b. Neurópteros nuevos o poco conocidos V serie. Memorias de la Real Academia de Ciencias Naturales de Barcelona, 9(27): 455-480. |
| ○ |
Navás, L., 1915c. Neuropteros nuevos de España (1a Serie). Revista de la Real Academia de Ciencias Exactas, Físicas y Naturales de Madrid, 14: 245-253. |
| ○ |
Navás, L., 1915d. Neurópteros nuevos o poco conocidos (sexta serie). Memorias de la Real Academia de Ciencias Naturales de Barcelona, 12(7): 119-136. |
| ○ |
Navás, L., 1916a. Excursiones por el norte de España. Congreso de la Asociación Española para el Progreso de las Ciencias, Valladolid 1915, 6: 161-179. |
| ○ |
Navás, L., 1916b. Neurópteros nuevos o poco conocidos 7a serie. Memorias de la Real Academia de Ciencias Naturales de Barcelona, 12: 219-243. |
| ○ |
Navás, L., 1916c. Excursión al valle de Arán (Lerida). Boletín de la Sociedad aragonesa de Ciencias Naturales, 15: 179-194. |
| ○ |
Navás, L., 1916d. Excursions entomològiques al nort de la provincia de LLeida. Butlletí de la Institució Catalana d’Història Natural, 16: 150-158. |
| ○ |
Navás, L., 1917a. Neurópteros nuevos o poco conocidos 8a serie. Memorias de la Real Academia de Ciencias Naturales de Barcelona, 13: 155-178. |
| ○ |
Navás, L., 1917b. Comunicaciones entomológicas. 2. Excursiones entomológicas por Aragón y Navarra. Revista de la Academia de Ciencias de Zaragoza, 2: 81-91. |
| ○ |
Navás, L., 1917c. Notas entomológicas. 2a serie. 14. Neurópteros de Andorra. Boletín de la Sociedad Aragonesa de Ciencias Naturales, 16: 36-46. |
| ○ |
Navás, L., 1918. Excursiones entomológicas por el norte de la provincia de Lérida. Butlletí de la Institució Catalana d’Història Natural, 18: 36-49. |
| ○ |
Navás, L., 1919a. Excursiones entomológicas por Cataluña durante el verano de 1918. Memorias de la Real Academia de Ciencias Naturales de Barcelona, 15: 181-214. |
| ○ |
Navás, L., 1919b. Once neurópteros nuevos españoles Boletín de la Sociedad Entomológica de España, 2,1: 48-56. |
| ○ |
Navás, L., 1919c. Notas entomológicas, 2a serie. Excursión anual de la Sociedad Aragonesa de Ciencias Naturales al Valle de Ordesa (Huesca) (22-29 de julio de 1918). Boletín de la Sociedad Ibérica de Ciencias Naturales, 18: 37-44. |
| ○ |
Navás, L., 1919d. Neurópteros de España nuevos. Segunda [II] serie. Boletín de la Sociedad Entomológica de España, 2: 218-223. |
| ○ |
Navás, L., 1921a. Excursiones científicas realizadas durante el verano de 1920. Congreso de la Asociación Española para el Progreso de las Ciencias, Oporto: 59-74. |
| ○ |
Navás, L., 1921b. Mis excursiones del verano de 1919. Memorias de la Real Academia de Ciencias Naturales de Barcelona, 17(6): 143-169. |
| ○ |
Navás, L., 1922a. Estudis sobre Neurópters. Arxius de l’Institut de Ciències, 7: 179-203. |
| ○ |
Navás, L., 1922b. Mis excursiones entomológicas durante el verano de 1921. Boletín de la Sociedad Entomológica de España, 5: 107-119. |
| ○ |
Navás, L., 1923. Excursions entomològiques de l’istiu de 1922 (26 de juny-26 de juliol). Arxius de l’Institut de Ciències, 8: 1-34. |
| ○ |
Navás, L., 1924a. Nueva especie de Neurópteros de la fauna española. Boletín de la Sociedad Entomológica de España, 7: 106-108. |
| ○ |
Navás, L., 1924b. Fauna de Catalunya. Entomologia de Catalunya. Neuròpters. Fascicle I. Neuròpters Propis. Publicacions de l’Institut d’Estudis Catalans, seccio de Ciències. Barcelona. 271 pp. |
| ○ |
Navás, L., 1924c. Mis excursiones entomológicas del verano de 1924. Brotéria (Serie Zoologica), 21(3): 115-150. |
| ○ |
Navás, L., 1924d. Excursió entomológica al Cabrerès (Girona-Barcelona). Musei Barcinonensis Scientiarum Naturalium Opera, 4(10): 1-59. |
| ○ |
Navás, L., 1925a. Sinopsis de los Neurópteros (Ins.) de la península ibérica. Memorias de la Sociedad Ibérica de Ciencias Naturales, 4: 1-149. |
| ○ |
Navás, L., 1925b. Mis excursiones del verano de 1925. Brotéria (Serie Zoologica), 22: 131-140. |
| ○ |
Navás, L., 1927a. Mis excursiones científicas en 1926. Revista de la Real Academia de Ciencias Exactas, Físico-Químicas y Naturales de Zaragoza, 10: 81-124. |
| ○ |
Navás, L., 1927b. Insectos recogidos en España por el doctor F. Haas Boletín de la Sociedad Entomológica de España, 10: 121-124. |
| ○ |
Navás, L., 1927c. Insekten aus der ehemaligen Ordnung der Neuropteren, gesammelt im nördlichen und östlichen Spanien, hauptsächlich von Dr. F. Haas in den Jahren 1914-1918. Senckenbergiana, 9(3/4): 112-114. |
| ○ |
Navás, L., 1928a. Excursiones por la provincia de Gerona. Butlletí de la Institució Catalana d’Història Natural, 8(1): 37-53. |
| ○ |
Navás, L., 1928b. Comunicaciones entomológicas. 10. Mis excursiones científicas en 1927. Revista de la Real Academia de Ciencias Exactas, Físico-Químicas y Naturales de Zaragoza, 11: 79-134. |
| ○ |
Navás, L., 1929a. Riqueza entomológica de España. X Congreso Internacional de Zoología, Budapest, 8: 1418-1426. |
| ○ |
Navás, L., 1929b. Excursiones por la provincia de Gerona en Julio y Agosto de 1928. Butlletí de la Institució Catalana d’Història Natural, (2), 9: 27-48. |
| ○ |
Navás, L., 1929c. Insectos neurópteros y afines. Boletín de la Sociedad Entomológica de España, 12: 38-42. |
| ○ |
Navás, L., 1929d. Excursiones por Aragón durante el verano de 1929. Boletín de la Sociedad Entomológica de España, 12: 122-132. |
| ○ |
Navás, L., 1930a. Excursión a Ribera de Cardós, Pallars (Lérida). Butlletí de la Institució Catalana d’Història Natural, 10: 48-57. |
| ○ |
Navás, L., 1930b. Excursió entomológica a la vall de Noguera de Cardós (LLeida). Butlletí de la Institució Catalana d’Història Natural, 10: 156-169. |
| ○ |
Navás, L., 1931a. De mis últimas excursiones entomológicas (1930-1931). Boletín de la Sociedad Entomológica de España, 14: 116-130. |
| ○ |
Navás, L., 1931b. Entomología del Pirineo. Resumen de la Conferencia del R.P. Longinos Navás, S. J. pronunciada el día 26 de Agosto de 1931. In: Curso de Conferencias y Excursiones sobre el Pirineo dado en la Universidad de Verano de Jaca los dís 24-30 de Agosto de 1931. Publicaciones de la Academia de Ciencias Exactas, Físico-Químicas y Naturales de Zaragoza. Zaragoza: 233-256. |
| ○ |
Navás, L., 1932. Fáunula de Sobradiel (Zaragoza). Revista de la Real Academia de Ciencias Exactas, Fíisico-Químicas y Naturales de Zaragoza, 16: 11-28. |
| ○ |
Needham, J. G., 1905. Systematic notes on Hemerobiidae. Bulletin of the New York State Museum, 86(Entomology 23): 15-17, 316. |
| ○ |
Needham, J. G., 1909. Notes on the Neuroptera in the collection of the Indian Museum. Records of the Indian Museum, 3: 185-210. |
| ○ |
Nel, A. [D.], Menier, J. J., Waller, A., Hodebert, G. & De Ploëg, G., 2003. New fossil spongilla-flies from the lowermost Eocene amber of France (Insecta, Neuroptera, Sisyridae). Geodiversitas, 25: 109-117. |
| ○ |
Nelson, J. D., Lambdin, P. L., Grant, J. F. & Mendel, Z., 2001. Predators attracted to the sex pheromones of Matsucoccus spp. (Margarodidae) in pine dominated forests. Bollettino di Zoologia Agraria e di Bachicoltura, 33: 409-416. |
| ○ |
Neuenschwander, P., 1975. Influence of temperature and humidity on the immature stages of Hemerobius pacificus. Environmental Entomology, 4: 215-220. http://dx.doi.org/10.1093/ee/4.2.215 |
| ○ |
Neuenschwander, P., 1976. Biology of the adult Hemerobius pacificus. Environmental Entomology, 5: 96-100. http://dx.doi.org/10.1093/ee/5.1.96 |
| ○ |
Neuenschwander, P. & Hagen, K. S., 1980. Role of the predator Hemerobius pacificus in a non-insecticide treated artichoke field. Environmental Entomology, 9: 492-495. http://dx.doi.org/10.1093/ee/9.5.492 |
| ○ |
Neuenschwander, P., Hagen, K. S. & Smith, R. F., 1975. Predation on aphids in California’s alfalfa fields. Hilgardia, 43: 53-71. http://dx.doi.org/10.3733/hilg.v43n02p053 |
| ○ |
New, T. R., 1966. Some notes on the biology of Psectra diptera (Burm.) (Neuroptera, Hemerobiidae). Entomologist’s Gazette, 17: 79-82. |
| ○ |
New, T. R., 1967a. Biological notes on Sympherobius pellucidus (Walk.), with a description of the larva (Neuroptera: Hemerobiidae). Entomologist’s Gazette, 18: 50-52. |
| ○ |
New, T. R., 1967b. The flight activity of some British Hemerobiidae and Chrysopidae, as indicated by suction-trap catches. Proceedings Proceedings of the Royal Entomological Society of London. Series A, General Entomology, 42: 93-100. http://dx.doi.org/10.1111/j.1365-3032.1967.tb01008.x |
| ○ |
New, T. R., 1968a. Sympherobius pygmaeus (Ramb.) (Neur., Hemerobiidae) in Berkshire, with a description of the cocoon and pupa. The Entomologist’s Monthly Magazine, 103: 171-172. |
| ○ |
New, T. R., 1968b. The dispersal of insects across sandy beaches, with special reference to larvae of Neuroptera. Entomologist’s Gazette, 19: 119-125. |
| ○ |
New, T. R., 1975a. Lacewings (Neuroptera) as biological control agents. Victorian Entomologist, 5: 102-103. |
| ○ |
New, T. R., 1975b. The biology of Chrysopidae and Hemerobiidae (Neuroptera), with reference to their usage as biocontrol agents: a review. Transactions of the Royal Entomological Society of London, 127: 115-140. http://dx.doi.org/10.1111/j.1365-2311.1975.tb00561.x |
| ○ |
New, T. R., 1975c. The immature stages of Drepanacra binocula (Neuroptera: Hemerobiidae), with notes on the relationships of the genus. Journal of the Australian Entomological Society, 14: 247-250. http://dx.doi.org/10.1111/j.1440-6055.1975.tb02035.x |
| ○ |
New, T. R., 1981. Redescription of Hemerobius australis Walker (Neuroptera, Hemerobiidae). Australian Entomological Magazine, 7(6): 97-99. |
| ○ |
New, T. R., 1984. Comparative biology of some Australian Hemerobiidae. In: J. Gepp, H. Aspöck & H. Hölzel (eds.). Progress in World’s Neuropterology (Proceedings of the 1st International Symposium on Neuropterology, September 1980, Graz). Graz: 153-166. |
| ○ |
New, T. R., 1986. A review of the biology of Neuroptera Planipennia. Neuroptera International, Supplemental Series, 1: 1-57. |
| ○ |
New, T. R., 1988a. A Revision of the Australian Hemerobiidae (Insecta: Neuroptera). Invertebrate Taxonomy, 2: 339-411. http://dx.doi.org/10.1071/IT9880339 |
| ○ |
New, T. R., 1988b. Hemerobiidae (Insecta: Neuroptera) from New Guinea. Invertebrate Taxonomy, 2: 605-632. http://dx.doi.org/10.1071/IT9880605 |
| ○ |
New, T. R., 1988c. Neuroptera. In: P. Harrewijn & A. K. Minks (eds.). Aphids, their biology, natural enemies and control, Vol. 2B. Elsevier. Amsterdam: 249-258. |
| ○ |
New, T. R., 1989. Planipennia, Lacewings. Handbuch der Zoologie, 4(30): 1-132. |
| ○ |
New, T. R., 1998. Are Neuroptera an informative focal group for conservation assessment? In: S. P. Panelius (ed.). Neuropterology 1997 (Proceedings of the Sixth International Symposium on Neuropterology, July 1997, Helsinki). Acta Zoologica Fennica, 209: 167-174. |
| ○ |
New, T. R., 1999. Neuroptera and biological control (Neuropterida). Stapfia, 60: 147-166. |
| ○ |
New, T. R., 2001. Introduction to the systematics and distribution of Coniopterygidae, Hemerobiidae, and Chrysopidae used in pest management. In: P. K. McEwen, T. R. New & A. E. Whittington (eds.). Lacewings in the crop environment. Cambridge University Press. Cambridge: 6-28. |
| ○ |
New, T. R., 2002. Prospects for extending the use of australian lacewings in biological control. Acta Zoologica Academiae Scientiarum Hungaricae, 48(Suppl. 2): 209-216. |
| ○ |
New, T. R., 2003. The Neuroptera of Malesia. Fauna Malesiana, vol. 4. Brill. Leiden. viii+204 pp. |
| ○ |
New, T. R. & Boros, C. [B.], 1983. The early stages of Micromus tasmaniae (Neuroptera: Hemerobiidae). Neuroptera International, 2: 213-217. |
| ○ |
Nielsen, E. S., 1977. En undersøgelse af netvingefaunaen (Neuroptera s. str.) i en dansk bøgeskov. Entomologiske Meddelelser, 45: 45-64. |
| ○ |
Novak, G. B., 1891. Terzo cenno sulla fauna dell’Isola Lesina in Dalmazia. Neuroptera. Societas Historico-Naturalis Croatica, 6: 50-58. |
| ○ |
Núñez Pérez, E., Marín, F. & Tizado, E. J., 1992. Contribución al conocimiento de los neurópteros (Neur., Hemerobiidae, Chrysopidae) depredadores de pulgones (Hom., Aphididae) sobre plantas cultivadas en León (España). Actas do V Congreso Ibérico de Entomología, Lisboa: 387-393. |
| ○ |
Ocharan, R. & Ocharan, F. J., 2011. Drepanepteryx phalaenoides (Linnaeus, 1758) (Neuoptera, Hemerobiidae) en Asturias (norte de España). Boletín de la Sociedad Entomológica Aragonesa, 48: 350. |
| ○ |
Ocharan, R., Ocharan, F. J. & Anadón, A., 2012. Neurópteros de la Reserva de la Biosfera de Muniellos (Asturias, Norte de España) (Neuroptera s. s., Megaloptera y Raphidioptera). Boletín de la Sociedad entomológica Aragonesa, 50: 421-429. |
| ○ |
Ohm, P., 1967. Zur Kenntnis der Gattung Boriomyia Banks 1905 (Neuroptera, Hemerobiidae). Reichenbachia, 8: 227-246. |
| ○ |
Ohm, P., 1973. Durch die Forstwirtschaft ermöglichte Vergrößerung der Verbreitungsareale nadelholzbewohnender Netzflügler (Neuroptera, Planipennia). Faunistisch-Ökologische Mitteilungen, 4: 299-304. |
| ○ |
Ohm, P. & Báez, M., 2004. Planipennia. In: I. Izquierdo Zamora, J. L. Martín Esquivel, N. Zurita Pérez & M. Arechavaleta Hernández (eds.). Lista de especies silvestres de Canarias (Hongos, Plantas y Animales Terrestres). Gobierno de Canarias. La Laguna: 207-208. |
| ○ |
Ohm, P. & Remane, R., 1968. Die Neuropterenfauna Hessen und einiger angrenzender Gabiete (zur Verbreitung der Neuropteren in Mitteleuropa). Faunistisch-Ökologische Mitteilungen, 3(6): 209-228. |
| ○ |
Oswald, J. D., 1985. A revision of the Nearctic species of Sympherobius Banks (Neuroptera: Hemerobiidae). Master’s thesis. Oregon State University. Corvallis. 116 pp. |
| ○ |
Oswald, J. D., 1987. A new species of Micromus from the western United States (Neuroptera: Hemerobiidae). Journal of the New York Entomological Society, 95: 1-4. |
| ○ |
Oswald, J. D., 1988a. A Revision of the Genus Sympherobius Banks (Neuroptera: Hemerobiidae) of America north of Mexico with a synonymical list of the world species. Journal of the New York Entomological Society, 96(4): 390-451. |
| ○ |
Oswald, J. D., 1988b. A review of the South Pacific genus Austromegalomus Esben-Petersen (Neuroptera: Hemerobiidae) with a description of a new species from Rapa. Proceedings of the Entomological Society of Washington, 90: 55-61. |
| ○ |
Oswald, J. D., 1990. Revision of the Neotropical Brown Lacewing Genus Nomerobius (Neuroptera: Hemerobiidae). Annals of the Entomological Society of America, 83(1): 18-29. http://dx.doi.org/10.1093/aesa/83.1.18 |
| ○ |
Oswald, J. D., 1991. Revision and cladistic analysis of the world genera of the family Hemerobiidae (Insecta: Neuroptera). Ph.D. dissertation. Cornell University. Ithaca. 399 pp. |
| ○ |
Oswald, J. D., 1993a. Revision and cladistic analysis of the world genera of the family Hemerobiidae (Insecta: Neuroptera). Journal of the New York Entomological Society, 101(2): 143-299. |
| ○ |
Oswald, J. D., 1993b. A new genus and species of brown lacewing from Venezuela (Neuroptera: Hemerobiidae), with comments on the evolution of the hemerobiid forewing radial vein. Systematic Entomology, 18: 363-370. http://dx.doi.org/10.1111/j.1365-3113.1993.tb00672.x |
| ○ |
Oswald, J. D., 1994. A new phylogenetically basal subfamily of brown lacewings from Chile (Neuroptera: Hemerobiidae). Entomologica Scandinavica, 25: 295-302. http://dx.doi.org/10.1163/187631294X00090 |
| ○ |
Oswald, J. D., 1996. A new brachypterous Nusalala species from Costa Rica, with coments on the evolution of flightlessness in brown lacewings (Neuroptera: Hemerobiidae). Systematic Entomology, 21: 343-352. http://dx.doi.org/10.1111/j.1365-3113.1996.tb00603.x |
| ○ |
Oswald, J. D., 1999. The brown lacewing genus Notiobiella (Neuroptera: Hemerobiidae) from Dominican amber. Journal of the New York Entomological Society, 107: 297-303. |
| ○ |
Oswald, J. D., 2004. Review of the brown lacewing genus Biramus (Neuroptera: Hemerobiidae: Hemerobiinae), with the description of a new species from Costa Rica and Panama. Tijdschrift voor Entomologie, 147: 41-47. http://dx.doi.org/10.1163/22119434-900000135 |
| ○ |
Oswald, J. D., 2013a. Neuropterida species of the world. A catalogue of the Species-Group names of the Extant and Fossil Neuroptera, Megaloptera, Raphidioptera and Glosselytrodea (Insecta: Neuropterida) of the World. Version 3.0. Disponible en: http://lacewing.tamu.edu/Species-Catalogue/index.html (última consulta diciembre 2014). |
| ○ |
Oswald, J. D., 2013b. Bibliography of the Neuropterida. An Annotated Bibliography and Digital Library of the Literature of the Extant and Fossil Neuroptera, Megaloptera, Raphidioptera and Glosselytrodea (Insecta: Neuropterida) of the World. Version 10.0. Disponible en: http://lacewing.tamu.edu/Bibliography/index.html (última consulta diciembre 2014). |
| ○ |
Oswald, J. D., Contreras-Ramos, A. & Penny, N. D., 2002. Neuroptera (Neuropterida). In: J. L. Bosquets & J. J. Morrone (eds.). Biodiversidad, taxonomía y biogeografia de Artrópodos de México: hacia una síntesis de su conocimiento, Vol. 3. Universidad Nacional Autónoma de México. México Distrito Federal: 559-581. |
| ○ |
Oswald, J. D. & Penny, N. D., 1991. Genus-group names of the Neuroptera, Megaloptera and Raphidioptera of the world. Occasional Papers of the California Academy of Sciences, 147: 1-94. |
| ○ |
Oswald, J. D. & Tauber, C. A., 2001. Recognition of larval Neuroptera. Preimaginal stages of the family Hemerobiidae. In: P. K. McEwen, T. R. New & A. E. Whittington (eds.). Lacewings in the crop environment. Cambridge University Press. Cambridge: 50-60. |
| ○ |
Panfilov, D. V., 1980. Novye predstaviteli setcharokrylykh (Neuroptera) iz yury Karatau. In: V. G. Dolin, D. V. Panfilov, A. G. Ponomarenko & L. N. Pritykina. Iskopaemye nasekomye mezozoya. Akademiya Nauk Ukrainskoi SSR, Institut Zoologii, Naukova Dumka. Kiev: 82-111. |
| ○ |
Pantaleoni, R. A., 1984. Note su alcuni parassiti (s.l.) di Neurotteri Planipenni con segnalazione del ritrovamento di Acari foretici su di un Crisopide. Bollettino dell’Istituto di Entomologia “Guido Grandi” della Università degli studi di Bologna, 38: 193-203. |
| ○ |
Pantaleoni, R. A., 1999. Neuropterida described by A. Costa with type designation. Deutsche Entomologische Zeitschrift (N.F.), 46: 249-261. http://dx.doi.org/10.1002/mmnd.4800460211 |
| ○ |
Pantaleoni, R. A., 2001. Lacewing occurrence in the agricultural landscape of Pianura Padana. In: P. K. McEwen, T. R. New & A. E. Whittington (eds.). Lacewings in the crop environment. Cambridge University Press. Cambridge: 447-470. |
| ○ |
Pantaleoni, R. A., 2010. Nomenclatural roots of Neuropterida: Linnaeus’ era. In: D. Devetak, S. Lipovšek & A. E. Arnett (eds.). (Proceedings of the 10th International Symposium on Neuropterology, June 2008, Piran). University of Maribor. Maribor: 215-229. |
| ○ |
Pantaleoni, R. A. & Alma, A., 2001. Lacewings and snake-flies in Piedmont vineyards (northwestern Italy). In: P. K. McEwen, T. R. New & A. E. Whittington (eds.). Lacewings in the crop environment. Cambridge University Press. Cambridge: 471-480. |
| ○ |
Parfin, S. I., 1956. Taxonomic notes on Kimminsia (Neuroptera; Hemerobiidae). Proceedings of the Entomological Society of Washington, 58: 203-209. |
| ○ |
Paulus, H. F., 1986. Comparative morphology of the larval eyes of Neuropteroidea. In: J. Gepp, H. Aspöck & H. Hölzel (eds.). Recent Research in Neuropterology (Proceedings of the 2nd International Symposium on Neuropterology, August 1984, Hamburg). Graz: 157-164. |
| ○ |
Penny, N. D., 1977. Lista de Megaloptera, Neuroptera e Raphidioptera do México, América Central, ilhas Caraíbas e América do Sul. Acta Amazonica, 7(4)(Suplemento): 1-61. |
| ○ |
Penny, N. D., Adams, P. A. & Stange, L. A., 1997. Species catalog of the Neuroptera, Megaloptera, and Raphidioptera of America North of Mexico. Proceedings of the California Academy of Sciences, (4), 50: 39-114. |
| ○ |
Penny, N. D., Arias, J. R. & Armistead, J. S., 2007. Seasonal emergence of Neuroptera in Fairfax County, Virginia. Proceedings of the California Academy of Sciences, (4), 58: 7-19. |
| ○ |
Penny, N. D. & Lee, V. F., 1996. Types of Mecoptera, Megaloptera, Raphidioptera, and Neuroptera (Insecta) in the collection of the California Academy of Sciences. Proceedings of the California Academy of Sciences, (4), 49: 127-149. |
| ○ |
Penny, N. D. & Monserrat, V. J., 1983. Neuroptera of the Amazon Basin. Part 10. Hemerobiidae. Acta Amazonica, 13: 879-909. |
| ○ |
Penny, N. D. & Sturm, H., 1984. A flightless brown lacewing from Colombia (Neuroptera: Hemerobiidae). Spixiana, 7: 19-22. |
| ○ |
Péringuey, L., 1910. Description of a new or little known species of the Hemerobiidae (Order Neuroptera) from South Africa. Annals of the South African Museum, 5: 433-454. |
| ○ |
Péringuey, L., 1911. Descriptions of four new species of South African Hemerobiidae (Order Neuroptera). Annals of the South African Museum, 10: 31-37. |
| ○ |
Perkins, R. C. L., 1899. Neuroptera. In: D. Sharp (ed.). Fauna Hawaiiensis being the land-fauna of the Hawaiian Islands, Vol. 2, pt. 2 (Neuroptera). Cambridge University Press. London: 31-89. |
| ○ |
Perkins, R. C. L., 1910. Supplement to Neuroptera. In: D. Sharp (ed.). Fauna Hawaiiensis being the land-fauna of the Hawaiian Islands, Vol. 2. Cambridge University Press. London: 691-696. |
| ○ |
Peters, R. S., Meusemann, K., Petersen, M., Mayer, C., Wilbrandt, J., Ziesmann, T., Donath, A., Kjer, K. M., Aspöck, U., Aspöck, H., Aberer, A., Stamatakis, A., Friedrich, F., Hünefeld, F., Niehuis, O., Beutel, R. G. & Misof, B., 2014. The evolutionary history of holometabolous insects inferred from transcriptome-based phylogeny and comprehensive morphological data. BMC Evolutionary Biology, 14: 52. http://dx.doi.org/10.1186/1471-2148-14-52 |
| ○ |
Peterson, A., 1967. Larvae of Insects, Vol. 2. (Coleoptera, Diptera, Neuroptera, Siphonaptera, Mecoptera, Trichoptera). 6th ed. Edwards Brothers. Ann Arbor. 416 pp. |
| ○ |
Pictet, A. E., 1865. Synopsis des Névroptères d’Espagne. H. Georg, Genèva & J. B. Baillière et Fils and F. Savy, Paris. 123 pp. |
| ○ |
Ping, C., 1928. Cretaceous fossil insects of China. Paleontologica Sinica (B), 13(1):1-56. |
| ○ |
Poggi, R., 1993. Catalogo dei tipi di Neurotteroidei del Museo Civico di Storia Naturale “G. Doria” di Genova (Insecta). Annali del Museo Civico di Storia Naturale “Giacomo Doria”, 89: 415-444. |
| ○ |
Ponomarenko, A. G., 1992. Novye setchatokrylye (Insecta, Neuroptera) iz mezozoya Mongolii. In: T. A. Grunt (ed.). Novye taksony iskopaemykh bespozronochnykh Mongolii. Akademiia nauk SSSR. Trudy - Sovmestnaya Sovetsko-Mongol’skaya Paleontologicheskaya Ekspeditsiya, 41: 101-111. |
| ○ |
Popov, A., 1986a. Die Hemerobiiden der Mongolei (Neuropteroidea: Planipennia). In: J. Gepp, H. Aspöck & H. Hölzel (eds.). Recent Research in Neuropterology (Proceedings of the 2nd International Symposium on Neuropterology, August 1984, Hamburg). Graz: 113-117. |
| ○ |
Popov, A., 1986b. Hemerobiiden aus Bulgarien (Neuroptera). Mitteilungen aus dem Zoologischen Museum in Berlin, 62: 323-331. http://dx.doi.org/10.1002/mmnz.4830620205 |
| ○ |
Popov, A., 1996. What is Boriomyia grisea Zeleny? With notes on two related European species of Wesmaelius Krüger (Insecta: Neuroptera: Hemerobiidae). In: M. Canard, H. Aspöck & M. W. Mansell (eds.). Pure and Applied Research in Neuropterology (Proceedings of the Fifth International Symposium on Neuropterology, May 1994, Cairo). Toulouse: 207-216. |
| ○ |
Popov, A., 2002a. Rare Chrysopidae and Hemerobiidae (Neuroptera) from Bulgaria. Historia Naturalis Bulgarica, 14: 73-78. |
| ○ |
Popov, A., 2002b. Neuropterida of northern Europe. Acta Zoologica Academiae Scientiarum Hungaricae, 48 (Suppl. 2): 281-291. |
| ○ |
Principi, M. M., 1958. Neurotteri dei Monti Sibillini (Appennino umbro-marchigiano). Memorie del Museo Civico di Storia Naturale di Verona, 6: 175-189. |
| ○ |
Principi, M. M., 1966. Contributi allo studio dei Neurotteri italiani XVIII. Neurotteri della Basilicata, della Calabria e della Sicilia. Memorie del Museo Civico di Storia Naturale di Verona, 14: 363-388. |
| ○ |
Pröse, H. & Gruppe, A. [V.], 2003. Rote Liste gefährdeter Netzflügler (Neuropteroidea) Bayerns. Schriftenreihe Bayerisches Landesamt für Umweltschutz, 166: 95-98. |
| ○ |
Quayle, H. J., 1913. Some natural enemies of spiders and mites. Journal of Economic Entomology, 6: 85-88. http://dx.doi.org/10.1093/jee/6.1.85 |
| ○ |
Rambur, [J.] P., 1842. Histoire Naturelle des Insectes, Névroptères. Librairie encyclopédique de Roret. Paris. [xviii]+534 pp. |
| ○ |
Reguilón, C., 2002. Morfología de los estados inmaduros de Hemerobius bolivari (Neuroptera: Hemerobiidae). Revista de la Sociedad Entomológica Argentina, 61: 63-68. |
| ○ |
Reguilón, C. & Nuñez Campero, S. R., 2005. Morfología de los estadios larvales de Sympherobius marmoratipennis (Neuroptera: Hemerobiidae). Revista de la Sociedad Entomológica Argentina, 64: 81-85. |
| ○ |
Reichholf, J. H., 2005a. Die Blattlausloewen Sympherobius elegans Stephens, 1836 und Hemerobius humulinus Linnaeus, 1758 in Lichtfallenfaengen im niederbayerischen Inntal (Neuroptera, Hemerobiidae). Entomofauna, 26: 381-388. |
| ○ |
Reichholf, J. H., 2005b. Lichtfang-Nachweise des “Blattfluegel-Taghafts” Drepanepteryx phalaenoides (Linnaeus, 1758) am unteren Inn (Neuroptera, Hemerobiidae). Entomofauna, 26: 389-392. |
| ○ |
Ren, D. & Hong, Y.-c., 1994. A cladistic study on the familial phylogeny of fossil and living Raphidioptera (Insecta). Bulletin of the Chinese Academy of Geological Sciences, 29: 103-117. |
| ○ |
Ribeiro, F. N., 1997. Protecção integrada em pomares de macieiras na rigiao de Alcobaça 4. Contribução para o conhecimento da fauna útil em Quercus coccifera L. Boletim da Sociedade Portuguesa de Entomologia, 169: 253-264. |
| ○ |
Riek, E. F., 1967. Structures of unknown, possibly stridulatory, function of the wings and body of Neuroptera; with an appendix on other endopterygote orders. Australian Journal of Zoology, 15: 337-348. http://dx.doi.org/10.1071/ZO9670337 |
| ○ |
Rivnay, E., 1943. A study on the efficiency of Sympherobius amicus Navas in controlling Pseudococcus citri Risso on citrus in Palestine [Neuroptera-Hemerobiidae and Hemiptera-Homoptera-Coccidae]. Bulletin de la Société Fouad 1er d’Entomologie, 27: 57-77. |
| ○ |
Robinson, K. A., Jonsson, M., Wratten, S. D., Wade, M. R. & Buckley, H. L., 2008. Implications of floral resources for predation by an omnivorous lacewing. Basic and Applied Ecology, 9: 172-181. http://dx.doi.org/10.1016/j.baae.2007.01.002 |
| ○ |
Röhricht, W., 2002. Neuroptera.com. Neuropteren im Internet-nutzt das was? Galathea Supplement, 13: 31-36. |
| ○ |
Röhricht, W., 2004. Rote Liste der Netzflügler i. w. S. (Neuropterida) des Landes Sachsen-Anhalt (2. Fassung, Stand: Februar 2004). Berichte des Landesamtes für Umweltschutz Sachsen-Anhalt, 39: 249-251. |
| ○ |
Röhricht, W. & Tröger, E. J., 1998. Rote Liste der Netzflügler (Neuropteroidea). In: M. Binot, R. Bless, P. Boye, H. Gruttke & P. Pretscher (eds.). Rote Liste gefährdeter Tiere Deutschlands. Schriftenreihe für Landschaftspflege und Naturschutz, 55: 231-234. |
| ○ |
Rosenhauer, W. G., 1856. Die thiere Andalusiens nach dem Resultate einer Reise zusammengestellt, nebst den Beschereinbungen von 249 neuen order bis jetzt noch unbeschreibenen Gattungen und Arten. Theodor Blaesing. Erlangen. 429 pp. |
| ○ |
Ruiz Torres, M. & Montiel Bueno, A., 2001. Introduccción al conocimiento de la entomofauna del olivar en la provincia de Jaén. Aspectos cuantitativos (II). Boletín de Sanidad Vegetal. Plagas, 27: 531-560. |
| ○ |
Ruiz Torres, M. & Montiel Bueno, A., 2002. Efectos del dimetoato usado en aplicaciones terrestres y aéreas sobre la entomofauna de olivar en la provincia de Jaén. Boletín de Sanidad Vegetal. Plagas, 28: 525-560. |
| ○ |
Rumbucher, K., 1995. Hemerobiidae (Insecta, Planipennia), eine bisher noch nicht entdeckte Familie der Santana Formation aus der brasilianischen Unterkreide. Bericht der Naturforschenden Gesellschaft Augsburg, 55: 46-61. |
| ○ |
Samson, P. R. & Blood, P. R. B., 1979. Biology and temperature relationships of Chrysopa sp., Micromus tasmaniae and Nabis capsiformis. Entomologia Experimentalis et Applicata, 25: 253-259. http://dx.doi.org/10.1111/j.1570-7458.1979.tb02877.x |
| ○ |
Samson, P. R. & Blood, P. R. B., 1980. Voracity and searching ability of Chrysopa signata (Neuroptera: Chrysopidae), Micromus tasmaniae (Neuroptera: Hemerobiidae) and Tropiconabis capsiformis (Hemiptera: Nabidae). Australian Journal of Zoology, 28: 575-580. http://dx.doi.org/10.1071/ZO9800575 |
| ○ |
Sato, T. & Takada, H., 2004. Biological studies on three Micromus species in Japan (Neuroptera: Hemerobiidae) to evaluate their potential as biological control agents against aphids: 1. Thermal effects on development and reproduction. Applied Entomology and Zoology, 39: 417-425. http://dx.doi.org/10.1303/aez.2004.417 |
| ○ |
Schedl, W., 1970. Planipennia (Insecta, Neuroptera) der subalpinen und höheren Stufen der Ötztaler Alpen (Tirol, Österreich). Bericht des Naturwissenschaftliche-Medizinischen Vereins in Innsbruck, 58: 305-312. |
| ○ |
Schlüter, T., 1986. The fossil Planipennia-a review. In: J. Gepp, H. Aspöck & H. Hölzel (eds.). Recent Research in Neuropterology (Proceedings of the 2nd International Symposium on Neuropterology, August 1984, Hamburg). Graz: 103-111. |
| ○ |
Schneider, W. G., 1845. Verzeichniss der von Herrn Oberlehrer Zeller im jahre 1844 in Sicilien und Italien gesammelten Neuroptera, mit beschreibung einiger neuen arten. Stettiner Entomologische Zeitung, 6: 338-346. |
| ○ |
Schneider, W. G., 1851. Symbolae ad monographiam generis Chrysopae, Leach. Quinque tabulis, in lapide acu delineatis illustratae. Ferdinandum Hirt. Vratislaviae. 175 pp. |
| ○ |
Schrank, F., 1781. Envmeratio insectorvm Avstriae indigenorum. Klett & Franck. Avgvstae Vindelicorvm. [xxii]+548 pp., 4 plates. |
| ○ |
Scudder, S. H., 1878. An account of some insects of unusual interest from the Tertiary rocks of Colorado and Wyoming. Bulletin of the United States Geological and Geographical Survey of the Territories, 4(2): 519-543. |
| ○ |
Séméria, Y. & Berland, L., 1988. Atlas des Névroptères de France et d’Europe. Mégaloptères, Raphidioptères, Nèvroptères Planipennes, Mécoptères. Nouvelle [2nd] édition revue et augmentée. Boubée. Paris. 190 pp. |
| ○ |
Şengonca, Ç., 1979. Beitrag zur Neuropterenfauna der Türkei. Nachrichtenblatt der Bayerischen Entomologen, 28: 10-15. |
| ○ |
Senior, L. J. & McEwen, P. K., 2001. The use of lacewings in biological control. In: P. K. McEwen, T. R. New & A. E. Whittington (eds.). Lacewings in the crop environment. Cambridge University Press. Cambridge: 296-302. |
| ○ |
Sherborn, C. D., 1937. On the dates of publication of Costa (O. G.) and (A.) Fauna del Regno di Napoli, 1829-1886. Journal of the Society for the Bibliography of Natural History, 1: 35-47. http://dx.doi.org/10.3366/jsbnh.1937.1.2.35 |
| ○ |
Simon, C. M., Gagné, W. C., Howarth, F. G. & Radovsky, F. J., 1984. Hawai′i: A Natural Entomological Laboratory. Bulletin of the Entomological Society of America, 30(3): 8-17. http://dx.doi.org/10.1093/besa/30.3.9 |
| ○ |
Smith, R. C., 1922. Hatching in three species of Neuroptera. Annals of the Entomological Society of America, 15: 169-176. http://dx.doi.org/10.1093/aesa/15.2.169 |
| ○ |
Smith, R. C., 1923. The life histories and stages of some hemerobiids and allied species (Neuroptera). Annals of the Entomological Society of America, 16: 129-151. http://dx.doi.org/10.1093/aesa/16.2.129 |
| ○ |
Smith, R. C., 1931. The Neuroptera of Haiti, West Indies. Annals of the Entomological Society of America, 24: 798-823. http://dx.doi.org/10.1093/aesa/24.4.798 |
| ○ |
Standfuss, M., 1910. Notes on the biology of Drepanepteryx phalaenoides L. The Entomologist’s Monthly Magazine, 46: 60-61. |
| ○ |
Stange, L. A., 1967. Catálogo de Neuroptera de Argentina y Uruguay. Acta Zoologica Lilloana, 22: 5-87. |
| ○ |
Steinmann, H., 1965a. Ergebnisse der zoologischen Forschungen von Dr. Z. Kaszab in der Mongolei (Neuroptera). 60. Chrysopidae, Hemerobiidae. Reichenbachia, 7: 179-190. |
| ○ |
Steinmann, H., 1965b. The Zoological results of Gy. Topál’s collectings in South Argentina. 19. Neuroptera, Hemerobiidae. Rovartani Közlemények (N.S.), 18: 567-574. |
| ○ |
Steinmann, H., 1968. Ergebnisse der zoologischen Forschungen von Dr. Z. Kaszab in der Mongolei (Neuroptera). 140. Chrysopidae und Hemerobiidae II. Reichenbachia, 11: 87-96. |
| ○ |
Steinmann, H., 1971. Ergebnisse der zoologischen Forschungen von Dr. Z. Kaszab in der Mongolei (Neuroptera). 217. Chrysopidae und Hemerobiidae III. Reichenbachia, 13: 251-262. |
| ○ |
Stelzl, M., 1990. Nahrungsanalytische untersuchungen an hemerobiiden-imagines (Insecta, Plainpennia). Mitteilungen der Deutschen Gesellschaft für Allgemeine und Angewandte Entomologie, 7: 670-676. |
| ○ |
Stelzl, M., 1991. Untersuchungen zu Nahrungsspektren mitteleuropäischer Neuropteren-Imagines (Neuropteroidea, Insecta) mit einer Diskussion über deren Nützlichkeit als Opponenten von Pflanzenschädlingen. Journal of Applied Entomology, 111: 469-477. http://dx.doi.org/10.1111/j.1439-0418.1991.tb00349.x |
| ○ |
Stelzl, M., 1992. Comparative studies on mouthparts and feeding habits of adult Raphidioptera and Neuroptera (Insecta: Neuropteroidea). In: M. Canard, H. Aspöck & M. W. Mansell (eds.). Current Research in Neuropterology (Proceedings of the Fourth International Symposium on Neuropterology, June 1991, Bagnères-de-Luchon). Toulouse: 341-347. |
| ○ |
Stelzl, M. & Devetak, D., 1999. Neuroptera in agricultural ecosystems. Agriculture, Ecosystems & Environment, 74: 305-321. http://dx.doi.org/10.1016/S0167-8809(99)00040-7 |
| ○ |
Stelzl, M. & Gepp, J., 1987. Nahrungsanalytische Untersuchungen an Imagines von Hemerobius micans (Olivier) (Planipennia, Hemerobiidae). Mitteilungen des Naturwissenschaftlichen Vereins für Steiermark, 117: 185-188. |
| ○ |
Stephens, J. F., 1836. Illustrations of British entomology; or, a synopsis of indigenous insects: containing their generic and specific distinctions; with an account of their metamorphoses, times of appearance, localities, food, economy, as far as practicable. Mandibulata Vol. 6. Baldwin and Cradock. London. 240 pp. |
| ○ |
Stroyan, H. L., 1949. A note on the biology of Eumicromus angulatus (Stephens) (Neuroptera, Hemerobiidae). The Entomologist, 82: 273-274. |
| ○ |
Souza, B., 1988. Aspectos morfologicos e biologicos de Nusalala uruguaya (Navás, 1923) (Neuroptera: Hemerobiidae) em condições de laborotorio. Escola superior de Agricultura de Lavras. 195 pp. |
| ○ |
Souza, B., 1997. Caracteres morfológicos externos dos estágios imaturos de Nusalala uruguaya (Navás, 1923) (Neuroptera: Hemerobiidae). Ciência e Agrotecnologia, 21: 267-274. |
| ○ |
Sugg, P. M., Greve, L. & Edwards, J. S., 1994. Neuropteroidea from Mount St. Helens and Mount Rainier: dispersal and immigration in volcanic landscapes. Pan-Pacific Entomologist, 70: 212-221. |
| ○ |
Syrett, P. & Penman, D. R., 1981. Developmental threshold temperatures for the brown lacewing, Micromus tasmaniae (Neuroptera Hemerobiidae). New Zealand Journal of Zoology, 8: 281-283. http://dx.doi.org/10.1080/03014223.1981.10427967 |
| ○ |
Szabó, S. & Szentkirályi, F., 1981. Communities of Chrysopidae and Hemerobiidae (Neuroptera) in some apple-orchards. Acta Phytopathologica Academiae Scientiarum Hungaricae, 16: 157-169. |
| ○ |
Szentkirályi, F., 1992. Spatio-temporal patterns of brown lacewings based on the Hungarian light trap network (Insecta: Neuroptera: Hemerobiidae). In: M. Canard, H. Aspöck & M. W. Mansell (eds.). Current Research in Neuropterology (Proceedings of the Fourth International Symposium on Neuropterology, June 1991, Bagnères-de-Luchon). Toulouse: 349-357. |
| ○ |
Szentkirályi, F., 1997. Seasonal flight patterns of some common brown lacewing species (Neuroptera, Hemerobiidae) in Hungarian agricultural regions. Biologia, 52: 291-302. |
| ○ |
Szentkirályi, F., 2001a. Ecology and habitat relationships. In: P. K. McEwen, T. R. New & A. E. Whittington (eds.). Lacewings in the crop environment. Cambridge University Press. Cambridge: 82-115. |
| ○ |
Szentkirályi, F., 2001b. Lacewings in fruit and nut crops. In: P. K. McEwen, T. R. New & A. E. Whittington (eds.). Lacewings in the crop environment. Cambridge University Press. Cambridge: 172-238. |
| ○ |
Szentkirályi, F., 2001c. Lacewings in vegetables, forests, and other crops. In: P. K. McEwen, T. R. New & A. E. Whittington (eds.). Lacewings in the crop environment. Cambridge University Press. Cambridge: 239-290. |
| ○ |
Szentkirályi, F. & Kristín, A., 2002. Lacewings and snakeflies (Neuroptera, Raphidioptera) as prey for bird nestlings in Slovakian forest habitats. Acta Zoologica Academiae Scientiarum Hungaricae, 48(Suppl. 2): 329-340. |
| ○ |
Sziráki, G., 1996. Ecological investigations of the Neuropteroidea of oak forests in Hungary (Insecta: Raphidioptera, Neuroptera). In: M. Canard, H. Aspöck & M. W. Mansell (eds.). Pure and Applied Research in Neuropterology (Proceedings of the Fifth International Symposium on Neuropterology, May 1994, Cairo). Toulouse: 229-232. |
| ○ |
Tauber, C. A. & Adams, P. A., 1990. Systematics of the Neuropteroidea: present status and future needs. In: M. Kosztarab & C. W. Schaefer (eds.). Systematics of the North American Insects and Arachnids: Status and Needs. Virginia Agricultural Experiment Station Information Series 90-1. Virginia Polytechnic Institute and State University. Blacksburg: 151-164. |
| ○ |
Tauber, C. A. & Krakauer, A. H., 1997. Larval characteristics and generic placement of endemic Hawaiian hemerobiids (Neuroptera). Pacific Science, 51: 413-423. |
| ○ |
Tauber, C. A., Tauber, M. J. & Giffin, J. G., 2007. Flightless Hawaiian Hemerobiidae (Neuroptera): comparative morphology and biology of a brachypterous species, its macropterous relative and intermediate forms. European Journal of Entomology, 104: 787-800. http://dx.doi.org/10.14411/eje.2007.100 |
| ○ |
Throne, A. L., 1971. The Neuroptera-Suborder Planipennia of Wisconsin. Part II. Hemerobiidae, Polystoechotidae and Sisyridae. Michigan Entomologist, 4: 79-87. |
| ○ |
Tillyard, R J., 1916. Studies in Australian Neuroptera. No. iv. The families Ithonidae, Hemerobiidae, Sisyridae, Berothidae, and the new family Trichomatidae; with a discussion of their characters and relationships, and descriptions of new and little-known genera and species. Proceedings of the Linnean Society of New South Wales, 41: 269-332. |
| ○ |
Tillyard, R J., 1917. Odonata, Planipennia, and Trichoptera from Lord Howe and Norfolk Islands. Proceedings of the Linnean Society of New South Wales, 42: 529-544. |
| ○ |
Tillyard, R. J., 1923. Descriptions of new species and varieties of lacewings (Order Neuroptera Planipennia) from New Zealand, belonging to the families Berothidae and Hemerobiidae. Transactions and Proceedings of the New Zealand Institute, 54: 217-225. |
| ○ |
Tillyard, R. J., 1926a. Planipennia. In: The Australian Encyclopaedia. Vol. 2. Angus and Robertson. Sydney: 305-306. |
| ○ |
Tillyard, R. J., 1926b. Neuropterida parts: Order Neuroptera (Alder-flies, Lacewings). In: The Insects of Australia and New Zealand. Angus and Robertson. Sydney: pp. 308-325, figs. U1-U17, pl. 22-24. |
| ○ |
Tjeder, B., 1930. Some notes on Sympherobius fuscescens Wallengr. Entomologisk Tidskrift, 51: 31-35. |
| ○ |
Tjeder, B., 1931. Boriomyia persica Mort., rava With., and baltica n. sp. Entomologisk Tidskrift, 52: 1-12. |
| ○ |
Tjeder, B., 1932. Preliminary notes on Hemerobius limbatellus of authors. Entomologisk Tidskrift, 53: 193-195. |
| ○ |
Tjeder, B., 1936a. Schwedisch-chinesische wissenschaftliche expedition nach den nordwestlichen provinzen Chinas, unter leitung von Dr. Sven Hedin und Prof. Sü Ping-chang. Insekten gesammelt vom schwedischen arzt der expedition Dr. David Hummel 1927-1930. 62. Neuroptera. Arkiv för Zoologi, 29A(8): 1-36. |
| ○ |
Tjeder, B., 1936b. Studies on Psectra diptera Burm. (Neuroptera, Hemerobiidae). Notulae Entomologicae, 16: 97-101. |
| ○ |
Tjeder, B., 1939. Die Arthropodenfauna von Madeira nach den Ergebnissen der Reise von Prof. Dr. O. Lundblad, Juli-August 1935. Arkiv för Zoologi, 31A(15): 1-58. |
| ○ |
Tjeder, B., 1941. Some remarks on “The generic names of the British Neuroptera.” Entomologisk Tidskrift, 62: 24-31. |
| ○ |
Tjeder, B., 1948. Neuroptera from the Azores and Madeira. Commentationes Biologicae, 8 (13): 1-12. |
| ○ |
Tjeder, B., 1952. Specimina typorum insectorum a Carolo Linnaeo descriptorum in Museo Degeeriano asservata. Pars III. Neuroptera. Entomologisk Tidskrift, 73: 203-206. |
| ○ |
Tjeder, B., 1955. Two new species of Boriomyia from South Africa (Neuroptera, Hemerobiidae). Annals of the South African Museum, 41: 381-385. |
| ○ |
Tjeder, B., 1957. A new European Hemerobius. Ergebnisse der Wissenschaftlichen Untersuchungen des Schweizerischen Nationalparks (N.F.), 5(36): 1-6. |
| ○ |
Tjeder, B., 1961. Neuroptera-Planipennia. The Lace-wings of Southern Africa. 4. Family Hemerobiidae. In: B. Hanström, P. Brinck & G. Rudebec (eds.). South African Animal Life. Vol. 8. Swedish Natural Science Research Council. Stockholm: 296-408. |
| ○ |
Tjeder, B., 1963a. Comments on Hemerobius algidus Erichson, with notes on the genus Drepanopteryx [sic] (Neur. Hemerobiidae). Opuscula Entomologica, 28: 171-180. |
| ○ |
Tjeder, B., 1963b. On the Neuroptera of the Azores. Boletim do Museu Municipal do Funchal, 17: 5-9. |
| ○ |
Tjeder, B., 1968. A new Wesmaelius from Central Asia (Neuroptera, Hemerobiidae). Entomologisk Tidskrift, 89: 137-140. |
| ○ |
Tjeder, B., 1975. A new genus and species of the Hemerobiidae from Nigeria (Insecta: Neuroptera). Entomologica Scandinavica, 6: 115-118. http://dx.doi.org/10.1163/187631275X00190 |
| ○ |
Tröger, E. J., 1993. Vorläufige Rote Liste gefährdeter Netzflügler (Neuropteroides) in Baden-Wüttemberg (Stand Juli 1992). Rote Listen der gefährdeter Tiere und Pflanzen, 3: 27-28. |
| ○ |
Tröger, E. J., 2007. Psectra diptera, auch in Spanien. DGaaE Nachrichten, 21:142-143. |
| ○ |
Tröger, E. J., 2009. Nachtrag zu “Tröger, E.J. (2007): Psectra diptera, auch in Spanien”. DGaaE Nachrichten, 23: 81. |
| ○ |
Vas, J., Ábrahám, L. & Markó, V., 1999. Study of nocturnal and diurnal activities of lacewings (Neuropteroidea: Raphidioptera, Neuroptera) by suction trap. Acta Phytopathologica et Entomologica Hungarica, 34: 149-152. |
| ○ |
Veenstra, C., Feichter, F. & Gepp, J., 1990. Larval diagnosis of the European genera of Hemerobiidae (Insecta: Neuroptera). In: M. W. Mansell & H. Aspöck (eds.). Advances in Neuropterology (Proceedings of the Third International Symposium on Neuropterology, February 1988, Berg en Dal). South African Department of Agricultural Development. Pretoria: 211-213. |
| ○ |
Vicente, M., 1902. Algunos insectos de Ortigosa. Boletín de la Sociedad Aragonesa de Ciencias Naturales, 1: 186-189. |
| ○ |
Vidal y López, M., 1943. Catálogo provisional de Neurópteros de la región levantina. Graellsia, 1(6): 13-24. |
| ○ |
Vidya, M., Ramegowda, G. K., Patil, R. K. & Lingappa, S., 2008. Studies on ovipositional preference of brown lacewing, Micromus igorotus Banks (Neuroptera: Hemerobiidae). Journal of Entomological Research, 32: 135-137. |
| ○ |
von Gleichen, W. F., 1770. Versuch einer Geschichte der Blatläuse und Blatlausfresser des Ulmenbaums nebst vier mit Farben erleuchteten Kupfertafeln. Nussbiegel. Nürnberg. [x]+28+[ii] pp. |
| ○ |
Walker, F., 1853. List of the specimens of neuropterous insects in the collection of the British Museum. Part II. (Sialides-Nemopterides). British Museum. London. [iii]+193-476. |
| ○ |
Wallengren, H. D. J., 1863. Bidrag till kännedomen af Sveriges Neuroptera. Öfversigt af Kongliga Vetenskaps-Akademiens Forhändlingar, 20: 15-26. |
| ○ |
Wallengren, H. D. J., 1871. Skandinaviens Neuroptera. Kungliga Svenska Wetenskaps Academiens Handlingar (N.F.), 9(8): 1-76. |
| ○ |
Weele, H. W. van der, 1910. Neuroptera. 2. Planipennia et Panorpata. In: Y. Sjöstedt (ed.). Wissenschaftliche ergebnisse der Schwedischen Zoologischen expedition nach dem Kilimandjaro, dem Meru und den Umgebenden massaisteppen Deutsch-Ostafrikas 1905-1906, 2(13): 11-23. |
| ○ |
Wegenek, E. G., 1950. Studies of the brown lacewings of California, with special emphasis on the genus Hemerobius Linnaeus (Order Neuroptera, Family Hemerobiidae). Ph.D. dissertation. University of California. Berkeley. 168 pp. |
| ○ |
Weitschat, W. & Wichard, W., 1998. Atlas der Pflanzen und Tiere im Baltischen Bernstein. Friedrich Pfeil. München. 256 pp., 92 pls. |
| ○ |
Whiting, M. F., Carpenter, J. C., Wheeler, Q. U. & Wheeler, W. C., 1997. The Strepsiptera problem: Phylogeny of the holometabolous insect orders inferred rom 18S and 28S ribosomal DNA sequences and morphology. Systematic Biology, 46: 1-68. http://dx.doi.org/10.1093/sysbio/46.1.1 |
| ○ |
Whittington, A. E., 2002. Resources in Scottish Neuropterology. Acta Zoologica Academiae Scientiarum Hungaricae, 48(Suppl. 2): 371-387. |
| ○ |
Williams, F. X., 1927. The brown Australian lacewing (Micromus vinaceus). Hawaiian Planters’ Record, 31: 246-249. |
| ○ |
Williams, C. B. & Killington, F. J., 1935. Hemerobiidae and Chrysopidae (Neur.) in a light trap at Rothamsted Experimental Station. Transactions of the Society for British Entomology, 2: 145-150. |
| ○ |
Winterton, S. L., 2003. Molecular phylogeny of Neuropterida with emphasis on the lacewings (Neuroptera). Entomologische Abhandlungen, 61: 158-160. |
| ○ |
Winterton, S. L., Hardy, N. B. & Wiegmann, B. M., 2010. On wings of lace: phylogeny and Bayesian divergence time estimates of Neuropterida (Insecta) based on morphological and molecular data. Systematic Entomology, 35: 349-378. http://dx.doi.org/10.1111/j.1365-3113.2010.00521.x |
| ○ |
Wise, K. A. J., 1973. New records in the New Zealand Neuroptera: Hemerobiidae. New Zealand Entomologist, 5(2): 181-185. http://dx.doi.org/10.1080/00779962.1973.9722997 |
| ○ |
Wise, K. A. J., 1993. Species of Micromus (Neuroptera: Hemerobiidae) in New Zealand. Records of the Auckland Institute and Museum, 30: 93-117. |
| ○ |
Wise, K. A. J., 2000. Re-evaluation of three species of Australasian Hemerobiidae (Insecta: Neuroptera). New Zealand Entomologist, 22: 15-21. http://dx.doi.org/10.1080/00779962.1999.9722051 |
| ○ |
Withycombe, C. L., 1922a. On the identity of Sympherobius (Hemerobius) elegans, Stephens (Neuroptera). The Entomologist, 55: 193-194. |
| ○ |
Withycombe, C. L., 1922b. The life-history of Hemerobius stigma, Steph. The Entomologist, 55: 97-99. |
| ○ |
Withycombe, C. L., 1923. A new British hemerobiid (Order Neuroptera). The Entomologist, 56: 202-204. |
| ○ |
Withycombe, C. L., 1925. Some aspects of the biology and morphology of the Neuroptera. With special reference to the immature stages and their possible phylogenetic significance. Transactions of the Royal Entomological Society of London, 72: 303-411. http://dx.doi.org/10.1111/j.1365-2311.1925.tb03362.x |
| ○ |
Yadav, A., He, X.-z. &Wang, Q., 2008. Effect of photoperiod on development and reproduction in Tasmanian lacewing Micromus tasmaniae (Walker) (Neuroptera: Hemerobiidae). New Zealand Plant Protection, 61: 338-342. |
| ○ |
Yadav, A., He, X.-z. & Wang, Q., 2009. Patterns of adult emergence and mating in Micromus tasmaniae (Walker) (Neuroptera: Hemerobiidae). New Zealand Plant Protection, 62: 179-183. |
| ○ |
Yadav, A., Wang, Q. & He, X.-z., 2010. Effect of body weight on reproductive performance of Micromus tasmaniae (Walker) (Neuroptera: Hemerobiidae). New Zealand Plant Protection, 63: 208-213. |
| ○ |
Yang, C.-k., 1964. Notes on the genus Neuronema of China (Neuroptera; Hemerobiidae). Dong Wu Fen Lei Xue Bao, 1: 261-282. |
| ○ |
Yang, C.-k., 1980a. Some new species of the genera Wesmaelius and Kimminsia (Neuroptera: Hemerobiidae). Kun Chong Xue Bao, 23: 54-65. |
| ○ |
Yang, C.-k., 1980b. Three new species of Sympherobius from China (Neuroptera: Hemerobiidae). Acta Agriculturae Universitatis Pekinensis, 6: 87-92. |
| ○ |
Yang, C.-k., 1981a. Neuroptera: Hemerobiidae. In: The Series of the Comprehensive Scientific Expedition to the Qinghai-Xizang Plateau. Insects of Xizang (Tibet), Vol. 1. Science Press. Peking: 301-321. |
| ○ |
Yang, C.-k., 1981b. The brown lace-wings of Mt. Wuyishan (Neuroptera: Hemerobiidae). Wuyi Ke Xue, 1: 191-196. |
| ○ |
Yang, C.-k., 1988. Neuroptera: Osmylidae, Dilaridae, Hemerobiidae, Chrysopidae, Mantispidae, Myrmeleontidae, Ascalaphidae, Corydalidae. In: F.-s. Huang, P.-y. Wang, W.-y. Yin, P.-y. Yu, T.-s. Lee, C.-k. Yang, & X.-j. Wang (eds.). Insects of Mt. Namjagbarwa region of Xizang. Science Press. Beijing: 193-216. |
| ○ |
Yang, C.-k., 1997. Neuroptera: Hemerobiidae. In: Yang, X.-k. (chief ed.). Insects of the Three Gorge Reservoir area of Yangtze river, Vol. 1. Chongqing Publishing House. Chongqing: 584-592. |
| ○ |
Yang, C.-k., 1999. Hemerobiidae. In: Huang, B.-k. (ed). [Fauna of Insects Fujian Province of China], Vol. 3. Fujian Science and Technology Press. Fuzhou: 102-106, 158-159. |
| ○ |
Yaseen, M. & Krishnaswamy, S., 1972. Neuroptera: Hemerobiidae. Neuroptera: Raphidiidae. Methods for rearing chrysopids and hemerobiids. In: V. P. Rao & M. Ghani (eds.). Studies on predators of Adelges spp. in the Himalayas. Miscellaneous Publication, Commonwealth Institute of Biological Control, 3: 50, 53-57. |
| ○ |
Zacwilichowski, J., 1938a. Materialy do fauny sieciarek (Neuroptera) Polski. Materialien zur Neuropteren Polens. Fragmenta Faunistica Musei Zoologici Polonici, 3, 15: 241-249. |
| ○ |
Zacwilichowski, J., 1938b. Dwa nowe dla polskiej fauny gatunki sieciarek (Neuroptera) i wykar gatunków po-danych dotychczas z Polski. Sprawozdanie Komisyi Fizjograficznej, 71: 35-40. |
| ○ |
Zelený, J., 1962a. A contribution to the knowledge of the order Neuroptera in Czechoslovakia. Casopis Ceskoslovenské Spolecnosti Entomologické, 59: 59-67. |
| ○ |
Zelený, J., 1962b. Stenomicromus lanosus n. sp., a new species of Neuroptera from Czechoslovakia (Neuroptera, Hemerobiidae). Casopis Ceskoslovenské Spolecnosti Entomologické, 59: 246-249. |
| ○ |
Zelený, J., 1963. Hemerobiidae (Neuroptera) from Czechoslovakia. Casopis Ceskoslovenské Spolecnosti Entomologické, 60: 55-67. |
| ○ |
Zelený, J., 1964. Ergebnisse der Albanien-Expedition 1961 des Deutschen entomologischen Institutes. 24 Beitrag Neuroptera. Beiträge zur Entomologie, 14: 323-336. |
| ○ |
Zelený, J., 1971. Neuroptera, Megaloptera und Mecoptera aus Bulgarien. Acta Faunistica Entomologica Musei Nationalis Pragae, 14:153-163. |
| ○ |
Zelený, J., 1972. Beiträge zur Kenntnis der Fauna Afghanistans (Sammelergebnisse von O. Jakes 1963-64, D. Povolny 1965, D. Povolny and Fr. Tenora 1966, J. Simek 1965-1966, D. Povolny, J. Gaisher, Z. Sebek & Fr. Tenara 1967). Neuroptera. Casopis Moravského Musea, 56/57: 183-188. |
| ○ |
Zelený, J., 1976. Vztah sítokrdlych (Neuroptera) k biotopum. Zprávy Ceskoslovenské Zoologické Spolecnosti, 197 (7-9): 45-47. |
| ○ |
Zelený, J., 1984. Flight activity of Czechoslovak Hemerobiidae and Chrysopidae: investigation by light trap. In: J. Gepp, H. Aspöck & H. Hölzel (eds.). Progress in World’s Neuropterology (Proceedings of the 1st International Symposium on Neuropterology, September 1980, Graz). Graz: 173-178. |
| ○ |
Zimmerman, E. C., 1940. Studies of Hawaiian Neuroptera. Proceedings of the Hawaiian Entomological Society, 10: 487-510. |
| ○ |
Zimmerman, E. C., 1946. A remarkable new Pseudopsectra from Maui (Neuroptera: Hemerobiidae). Proceedings of the Hawaiian Entomological Society, 12: 659-660. |
| ○ |
Zimmerman, E. C., 1957. Insects of Hawaii: A Manual of the Insects of the Hawaiian Islands, including an Enumeration of the Species and Notes on their Origin, Distribution, Hosts, Parasites, etc. Vol. 6. University of Hawaii Press. Honolulu. xi+209 pp. |
Figs. 1-12.— Hemeróbidos en su ambiente: 1-2: Sympherobius fallax; 3: Megalomus sp., probablemente M. hirtus; 4: Hemerobius gilvus; 5: Megalomus sp., probablemente M. tineoides; 6: Micromus angulatus; 7: Micromus variegatus; 8: Hemerobius micans; 9: Micromus angulatus; 10: Wesmaelius subnebulosus; 11: Drepanepteryx phalaenoides; 12: Wesmaelius quadrifasciatus. Fotos 1-4 y 6 de Isidro Martínez; 5 de Francisco Rodríguez (http://faluke.blogspot.com.es/search/label/neuroptera); 7 y 9 de José Ramón Pato (http://www.faunayflora.net/index.php); 8 de Santiago Pagola; 10 de José Ignacio L. Colón; 11 de Johannes Gepp & Edith Winkler; 12 de Johannes Gepp (tomada de
Gepp, 1999).